摘要:由此可以断定( )
网址:http://m.1010jiajiao.com/timu_id_499132[举报]
1.B 2.B 3.B 4.B 5.A 6.BD 7.A 8.A 9.AD 10.A 11.AD
12.CD 13.C 14.A 15.B 16.D 17.D 18.C 19.A 20.B 21.A 22.B
23.(1)E、 、
、 (2)D、
(2)D、 、
、 (3)A、
(3)A、 、
、 (4)D、
(4)D、 、
、 .
.
24.①
②
③
④
25.(1)磺酸基 H亦有较强的酸性
H亦有较强的酸性 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
(2)A  (3)
(3)

26.(1) (2)
(2) (3)②⑤
(3)②⑤
(4)
n 

(2)①

②

(2)①②③④
29.


(2)可以,因为该反应的总反应式为 ,原子利用率=34/34×100%=100%,故可称为理想状态
,原子利用率=34/34×100%=100%,故可称为理想状态
30.(1)A、D (2)除去过量的硫粉 (3)
(4) 生成
生成 :
: ,∴ 未饱和
,∴ 未饱和
(5)B (6)设析出的晶体质量为x(g)
30×1.14-18.9=15.3(g) 
∴ x=23.1(g) www.ks5u.com
www.ks5u.com
(2013?上饶一模)某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L
甲同学欲探究废水的组成,进行了如下实验
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
Ⅱ.取少量溶液,加入KSCN溶液无明显变化.
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变
Ⅳ. 向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是
(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式
(4)甲同学最终确定原溶液中所含阳离子是
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为
(6)工业废水中常含有不同类型的污染物,可采用不同的方法处理.以下是乙同学针对含不同污染物的废水提出的处理措施和方法,其中正确的是
查看习题详情和答案>>
| 阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl-CO32- NO3- SO42- SiO32- |
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
Ⅱ.取少量溶液,加入KSCN溶液无明显变化.
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变
Ⅳ. 向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是
K+、Fe3+
K+、Fe3+
(写离子符号).(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是
3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
.(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式
3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
(4)甲同学最终确定原溶液中所含阳离子是
Fe2+、Cu2+
Fe2+、Cu2+
,阴离子是Cl-、NO3-、SO42-
Cl-、NO3-、SO42-
.(写离子符号)(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为
1.6
1.6
g.(6)工业废水中常含有不同类型的污染物,可采用不同的方法处理.以下是乙同学针对含不同污染物的废水提出的处理措施和方法,其中正确的是
D
D
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 废酸 | 加生石灰中和 | 物理法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含复杂有机物的废水 | 通过微生物代谢 | 物理法 |
| D | 碱性的废水 | 用CO2来中和 | 化学法 |
(2013?临沭县模拟)镉离子(Cd2+)是重金属冶炼工业污水中的一种离子.处理含镉废水常用化学沉淀法.回答下面的问题.
(1)以下是几种镉的难溶化合物的溶度积常数(25℃):
根据上表提供的信息判断,沉淀Cd2+效果最佳的试剂是
a.Na2CO3 b.Na2S c.CaO
(2)如图1所示为某化工厂处理含Cd2+废水的流程:
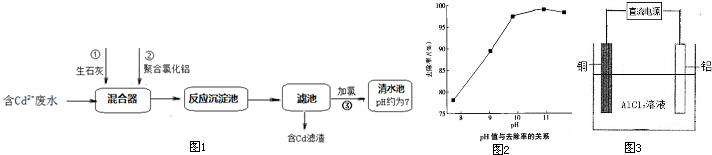
①写出加入生石灰后发生反应的离子方程式:
②聚合氯化铝[Al2(OH)nClx-n]是一种无机高分子聚合物,分子式中x=
③如图2是随污水的pH升高Cd2+去除率的变化图象,由图象可知,处理含Cd2+污水的最佳pH=
(3)在特定的电解槽中,用铝、铜作电极,氯化铝作电解液,制备聚合氯化铝(示意图如图3),电解反应为:Al+H2O+AlCl3
[Al2(OH)nClx-n]+H2
①铝作电解池的
②该电解池的阴极电极反应为
查看习题详情和答案>>
(1)以下是几种镉的难溶化合物的溶度积常数(25℃):
| 含镉难溶物 | CdCO3 | CdS | Cd(OH)2 |
| 溶度积常数 | 5.2×10-12 | 3.6×10-29 | 2.0×10-16 |
b
b
a.Na2CO3 b.Na2S c.CaO
(2)如图1所示为某化工厂处理含Cd2+废水的流程:

①写出加入生石灰后发生反应的离子方程式:
CaO+H2O=Ca2++2OH-、Cd2++2OH-=Cd(OH)2↓
CaO+H2O=Ca2++2OH-、Cd2++2OH-=Cd(OH)2↓
.②聚合氯化铝[Al2(OH)nClx-n]是一种无机高分子聚合物,分子式中x=
6
6
.③如图2是随污水的pH升高Cd2+去除率的变化图象,由图象可知,处理含Cd2+污水的最佳pH=
11
11
(取正整数),此时溶液中c(Cd2+)=2.0×10-10 mol?L-1
2.0×10-10 mol?L-1
.(3)在特定的电解槽中,用铝、铜作电极,氯化铝作电解液,制备聚合氯化铝(示意图如图3),电解反应为:Al+H2O+AlCl3
| 通电 |
①铝作电解池的
阳
阳
(填“阴”或“阳”)极.②该电解池的阴极电极反应为
2H++2e-=H2↑
2H++2e-=H2↑
.(2009?上海一模)工业生产硝酸铵的流程图如图:

请回答下列问题:
(1)写出硝酸铵在工农业生产中的重要作用
(2)已知N2(g)+3H2(g)═2NH3(g),△H=-92kJ?mol-1.请回答:
①在500℃、200atm和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量
②为有效提高氢气的转化率,实际生产中宜采取的措施有
A.降低温度 B.最适合催化剂活性的适当高温 C.增大压强
D.降低压强 E.循环利用和不断补充氮气 F.及时移出氨
(3)已知铂铑合金网未预热也会发热.写出氨催化氧化的化学方程式:
,当温度升高时,K值
(4)在一定温度和压强的密闭容器中,将平均式量为8.5的H2和N2混合,当该反应达到平衡时,测出平衡混合气的平均式量为10,此时N2的转化率为
查看习题详情和答案>>

请回答下列问题:
(1)写出硝酸铵在工农业生产中的重要作用
可做氮肥等
可做氮肥等
(任写一条)(2)已知N2(g)+3H2(g)═2NH3(g),△H=-92kJ?mol-1.请回答:
①在500℃、200atm和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量
<
<
(填“<”“>”“=”)92.4kJ,理由是在1atm和298K条件下,1mol氮气和3mol氢气完全反应生成2mol氨气,放出92.4kJ热量,该反应为可逆反应,不可能进行完全,又因为反应温度为500℃,所以放出的热量小于92.4kJ
在1atm和298K条件下,1mol氮气和3mol氢气完全反应生成2mol氨气,放出92.4kJ热量,该反应为可逆反应,不可能进行完全,又因为反应温度为500℃,所以放出的热量小于92.4kJ
.②为有效提高氢气的转化率,实际生产中宜采取的措施有
CEF
CEF
A.降低温度 B.最适合催化剂活性的适当高温 C.增大压强
D.降低压强 E.循环利用和不断补充氮气 F.及时移出氨
(3)已知铂铑合金网未预热也会发热.写出氨催化氧化的化学方程式:
4NH3+5O2
4NO+6H2O
| ||
4NH3+5O2
4NO+6H2O
,该反应的化学平衡常数表达式K=
| ||
| C4(NO)?C6(H2O) |
| C4(NH3)?C5(O2) |
| C4(NO)?C6(H2O) |
| C4(NH3)?C5(O2) |
减小
减小
(增大、减小、无影响),其原因是因为氨的催化氧化反应是放热反应,所以升高温度,K会减小.
因为氨的催化氧化反应是放热反应,所以升高温度,K会减小.
.(4)在一定温度和压强的密闭容器中,将平均式量为8.5的H2和N2混合,当该反应达到平衡时,测出平衡混合气的平均式量为10,此时N2的转化率为
30%
30%
. (2009?海口模拟)Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于下表:
(2009?海口模拟)Mn、Fe均为第四周期过渡元素,两元素的部分电离能(I)数据列于下表:| 元素 | Mn | Fe | |
| 电离能/kJ?mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
(1)Mn元素价电子层的电子排布式为
3d54s2
3d54s2
,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是由Mn2+转化为Mn3+时,3d能经由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态)
由Mn2+转化为Mn3+时,3d能经由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态)
.(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物,则与Fe原子或离子形成配合物的分子或离子应具备的条件是
具有孤对电子
具有孤对电子
.(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂,据此判断三氯化铁晶体为
分子
分子
晶体.(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为
2:1
2:1
,其中体心立方晶胞空间利用率为68%
68%
.(2011?顺义区二模)甲烷是一种重要的基础化工原料,不仅可制备多种重要有机产品,还可用于环境保护.请回答下列问题:(1)用甲烷催化还原氮的氧化物可消除氮氧化物的污染.已知:
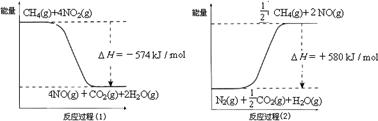
反应过程(2)是
(2)工厂利用甲烷与氯气的反应原理制取氯甲烷,为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应:
CCl4(g)+H2(g)?CHCl3(g)+HCl(g),使CCl4转化为重要的化工原料氯仿(CHCl3)(不考虑副反应).
在固定容积为2L的密闭容器中,该反应达到平衡后,测得如下数据:
①此反应在110℃时平衡常数为
③判断该反应的正反应是
④为提高实验3中CCl4的转化率,可采取的措施是
a.使用高效催化剂 b.向容器中再投入1mol CCl4和1mol H2
c.温度升高到200℃d.向容器中再投入1mol HCl e.向容器中再投入1mol H2.
查看习题详情和答案>>

反应过程(2)是
吸热
吸热
反应(填“放热”或“吸热”),甲烷还原NO2生成H2O(g)、N2和CO2时的热化学方程式是2CH4(g)+4NO2(g)=2CO2(g)+2N2(g)+4H2O(g)△H=-1734kJ/mol
2CH4(g)+4NO2(g)=2CO2(g)+2N2(g)+4H2O(g)△H=-1734kJ/mol
.(2)工厂利用甲烷与氯气的反应原理制取氯甲烷,为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应:
CCl4(g)+H2(g)?CHCl3(g)+HCl(g),使CCl4转化为重要的化工原料氯仿(CHCl3)(不考虑副反应).
在固定容积为2L的密闭容器中,该反应达到平衡后,测得如下数据:
| 实验 序号 |
温度℃ | 初始n(CCl4) (mol) |
初始n(H2) (mol) |
平衡时n(CHCl3) (mol) |
| 1 | 110 | 0.8 | 1.2 | |
| 2 | 110 | 2 | 2 | 1 |
| 3 | 100 | 1 | 1 | 0.6 |
1
1
. ②实验l中,CCl4的转化率为60%
60%
.③判断该反应的正反应是
放热
放热
(填“放热”或“吸热”),理由是温度为100℃时,K=2.25,大于110℃时的平衡常数,所以该反应为放热反应
温度为100℃时,K=2.25,大于110℃时的平衡常数,所以该反应为放热反应
.④为提高实验3中CCl4的转化率,可采取的措施是
e
e
.a.使用高效催化剂 b.向容器中再投入1mol CCl4和1mol H2
c.温度升高到200℃d.向容器中再投入1mol HCl e.向容器中再投入1mol H2.



