摘要:19.已知立方烷的空间结构为.下列说法正确的是A.立方烷的分子式为C8H16B.立方烷能与溴水发生加成反应C.立方烷可与浓硝酸发生酯化反应
网址:http://m.1010jiajiao.com/timu_id_49750[举报]
一、(共44分,每小题2分)
题号
1
2
3
4
5
6
7
8
9
10
11
答案
B
C
B
D
B
C
C
A
B
D
A
题号
12
13
14
15
16
17
18
19
20
21
22
答案
A
A
C
A
D
C
A
D
B
C
B
二、(本题包括3小题,共22分)
23.(共8分,每空2分)
⑴无 ⑵NO2;H2O、AgNO3溶液(其它合理答案均给分)
⑶H2(g)+1/2O2(g) H2O(l);△H=-285.8kJ?mol-1
H2O(l);△H=-285.8kJ?mol-1
24.(共10分,每空2分)
⑴2Al+2OH-+2H2O===2AlO2-+3H2↑;不能
⑵ ;2NaHCO3
;2NaHCO3 Na2CO3+H2O+CO2↑ ⑶三角锥形
Na2CO3+H2O+CO2↑ ⑶三角锥形
25.(共4分,每空2分)
⑴N ⑵非极性
三、(本题包括2小题,共12分)
26.(共4分,每空2分)
⑴分液漏斗 ⑵NaOH固体或碱石灰
27.(共8分,每空2分)
⑴b ⑵浓硫酸 (3)②③①⑤④(或③②①⑤④)
(4)吸收多余Cl2,防止空气中的水蒸气进入反应应器使S2Cl2水解
四、(本题包括2小题,共12分)
28.(共4分,每空2分)
⑴能 ⑵3
29.(共8分,每空2分)
⑴羟基 ⑵消去反应
⑶ ⑷
⑷
五、(本题包括2小题,共10分)
30.(共6分)v(H2SO4)=200mL;c(Cu2+)=0.5mol?L-1
31.(共4分,每空2分)
⑴94.6% ⑵13
【物质结构与性质】
(1)金属镁有许多重要的用途,格利雅试剂的结构简式可表示为RMgX,它是金属镁和卤代烃反应的产物,简称格氏试剂,它在醚的稀溶液中以单体形式存在,并与二分子醚络合,在浓溶液中以二聚体存在,结构如下图:


上述2种结构中均存在配位键,把你认为是配位键的用“→”标出.
(2)在短周期主族元素中,氯及其相邻元素的电负性由大到小的顺序是
(3)A、B、C为同一短周期金属元素.依据下表数据分析,C元素在化合物中的主要化合价为
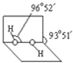 (4)已知过氧化氢分子的空间结构如图所示,分子中氧原子采取
(4)已知过氧化氢分子的空间结构如图所示,分子中氧原子采取
(5)R是1~36号元素中未成对电子数最多的原子.R3+在溶液中存在如下转化关系:
①基态R原子的价电子排布式为
②[R(OH)4]-中存在的化学键是
A.离子键 B.极性键 C.非极性键 D.配位键.
查看习题详情和答案>>
(1)金属镁有许多重要的用途,格利雅试剂的结构简式可表示为RMgX,它是金属镁和卤代烃反应的产物,简称格氏试剂,它在醚的稀溶液中以单体形式存在,并与二分子醚络合,在浓溶液中以二聚体存在,结构如下图:


上述2种结构中均存在配位键,把你认为是配位键的用“→”标出.
(2)在短周期主族元素中,氯及其相邻元素的电负性由大到小的顺序是
F>Cl>S
F>Cl>S
(用元素符号表示)(3)A、B、C为同一短周期金属元素.依据下表数据分析,C元素在化合物中的主要化合价为
+3
+3
;第二电离能(I2)B小于A的原因是A+外层电子排布为2s22p6稳定结构,难再失去一个电子.B+外层电子排布为3s1,易失去一个电子
A+外层电子排布为2s22p6稳定结构,难再失去一个电子.B+外层电子排布为3s1,易失去一个电子
.| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 500 | 4600 | 6900 | 9500 |
| B | 740 | 1500 | 7700 | 10500 |
| C | 580 | 1800 | 2700 | 11600 |
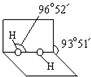
 (4)已知过氧化氢分子的空间结构如图所示,分子中氧原子采取
(4)已知过氧化氢分子的空间结构如图所示,分子中氧原子采取sp3
sp3
杂化;通常情况下,H2O2与水任意比互溶的主要原因是H2O2分子H2O分子之间形成氢键,使H2O2与水任意比互溶
H2O2分子H2O分子之间形成氢键,使H2O2与水任意比互溶
.(5)R是1~36号元素中未成对电子数最多的原子.R3+在溶液中存在如下转化关系:

①基态R原子的价电子排布式为
3d54s1
3d54s1
.②[R(OH)4]-中存在的化学键是
BD
BD
.A.离子键 B.极性键 C.非极性键 D.配位键.
(2011?扬州三模)(1)在短周期主族元素中,氯及其相邻两元素的电负性由大到小的顺序是
(2)A、B、C为同一短周期金属元素.依据下表数据分析,C元素在化合物中的主要化合价为
(3)已知过氧化氢分子的空间结构如右图所示,分子中氧原子采取
通常情况下,H2O2与水任意比互溶的主要原因是
(4)R是1~36号元素中未成对电子数最多的原子.R3+在溶液中存在如下转化:R3+ R(OH)3
R(OH)3 [R(OH)4]-
[R(OH)4]-
①基态R原子的价电子排布式为
A.离子键 B.极性键 C.非极性键 D.配位键
(5)等电子体原理可广义理解为:重原子数相等(重原子指原子序数≥4),总电子数或价电子数相等的分子或离子.若将H2O2滴入液氨中,可得白色固体A,红外光谱显示,A中有阴阳两种离子,阳离子是正四面体,阴离子与H2O2互为等电子体.则A的结构简式为
查看习题详情和答案>>
F>Cl>S
F>Cl>S
(用元素符号表示)(2)A、B、C为同一短周期金属元素.依据下表数据分析,C元素在化合物中的主要化合价为
+3
+3
;A、B、C三种元素的原子半径由大到小的顺序是Na>Mg>Al
Na>Mg>Al
.| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 500 | 4600 | 6900 | 9500 |
| B | 740 | 1500 | 7700 | 10500 |
| C | 580 | 1800 | 2700 | 11600 |
sp3
sp3
杂化;通常情况下,H2O2与水任意比互溶的主要原因是
H2O2分子H2O分子之间形成氢键,使H2O2与水任意比互溶
H2O2分子H2O分子之间形成氢键,使H2O2与水任意比互溶
.(4)R是1~36号元素中未成对电子数最多的原子.R3+在溶液中存在如下转化:R3+
 R(OH)3
R(OH)3 [R(OH)4]-
[R(OH)4]-①基态R原子的价电子排布式为
3d54s1
3d54s1
.②[R(OH)4]-中存在的化学键是BD
BD
.A.离子键 B.极性键 C.非极性键 D.配位键
(5)等电子体原理可广义理解为:重原子数相等(重原子指原子序数≥4),总电子数或价电子数相等的分子或离子.若将H2O2滴入液氨中,可得白色固体A,红外光谱显示,A中有阴阳两种离子,阳离子是正四面体,阴离子与H2O2互为等电子体.则A的结构简式为
NH4OOH
NH4OOH
. (1)在短周期主族元素中,氯及其相邻元素的电负性由大到小的顺序是
(1)在短周期主族元素中,氯及其相邻元素的电负性由大到小的顺序是(2)A、B、C为同一短周期金属元素.依据下表数据分析,C元素在化合物中的主要化合价为
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 500 | 4600 | 6900 | 9500 |
| B | 740 | 1500 | 7700 | 10500 |
| C | 580 | 1800 | 2700 | 11600 |
(4)R是1~36号元素中未成对电子数最多的原子.R3+在溶液中存在如下转化关系:R3+
| OH- |
| H+ |
| ||
| H+ |
①基态R原子的价电子排布式为
②[R(OH)4]-中存在的化学键是
A.离子键 B.极性键 C.非极性键 D.配位键. 查看习题详情和答案>>
开发太阳能资源是当前科技研发的热点.
(1)某太阳能吸热涂层以镍或镍合金空心球为吸收剂,基态镍原子M层上的未成对电子数为 .
(2)有机太阳能固体电池材料含有高纯度C60,其结构如图1,则1mol C60分子中π键的数目为 .
(3)硅太阳能电池中有一种金属镁酞菁配合物,结构如下图2.该结构中,碳氮之间的共价键类型有 (按原子轨道重叠方式填写共价键的类型),请在下图2中用箭头表示出配位键.

(4)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等.
①第一电离能:As Se(填“>”、“<”或“=”).
②硫化锌的晶胞中(结构如图3所示),硫离子的配位数是 .
(5)已知过氧化氢分子的空间结构如图4所示,分子中氧原子采取 杂化;通常情况下,H2O2与水任意比互溶的主要原因是 .
查看习题详情和答案>>
(1)某太阳能吸热涂层以镍或镍合金空心球为吸收剂,基态镍原子M层上的未成对电子数为
(2)有机太阳能固体电池材料含有高纯度C60,其结构如图1,则1mol C60分子中π键的数目为
(3)硅太阳能电池中有一种金属镁酞菁配合物,结构如下图2.该结构中,碳氮之间的共价键类型有

(4)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等.
①第一电离能:As
②硫化锌的晶胞中(结构如图3所示),硫离子的配位数是
(5)已知过氧化氢分子的空间结构如图4所示,分子中氧原子采取
(2011?龙岩模拟)化学--物质结构与性质
I、为减少温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2.
(1)若有1mol CH4生成,则有
(2)CH4失去H-(氢负离子)形成CH+3(甲基正离子).已知CH+3的空间结构是平面正三角形,则CH+3中碳原子的杂化方式为
Ⅱ、金属原子与CO形成的配合物称为金属羰基配合物(如羰基铁).形成配合物时,每个CO提供一对电子与金属原子形成配位键,且金属原子的价电子和CO提供的电子总和等于18.
(3)金属羰基配合物中,微粒间作用力有
a、离子键 b、共价键 c、配位键 d、金属键
(4)羰基铁是一种黄色油状液体,熔点-21℃、沸点102.8℃.由此推测,固体羰基铁更接近于
III.研究表明,对于中心离子为Hg+等阳离子的配合物,若配位体给出电子能力越强:则配位体与中心离子形成的配位键就越强,配合物也就越稳定.
(5)预测HgCl24与HgI2-4的稳定性强弱,并从元素电负性的角度加以解释.
答:HgCl2-4比HgI2-4更
查看习题详情和答案>>
I、为减少温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2.
(1)若有1mol CH4生成,则有
6
6
molσ键和2
2
molπ键断裂.(2)CH4失去H-(氢负离子)形成CH+3(甲基正离子).已知CH+3的空间结构是平面正三角形,则CH+3中碳原子的杂化方式为
SP2
SP2
.Ⅱ、金属原子与CO形成的配合物称为金属羰基配合物(如羰基铁).形成配合物时,每个CO提供一对电子与金属原子形成配位键,且金属原子的价电子和CO提供的电子总和等于18.
(3)金属羰基配合物中,微粒间作用力有
bc
bc
(填字母代号)a、离子键 b、共价键 c、配位键 d、金属键
(4)羰基铁是一种黄色油状液体,熔点-21℃、沸点102.8℃.由此推测,固体羰基铁更接近于
分子晶体
分子晶体
(填晶体类型).若用Fe(CO)x表示羰基铁的化学式,则x=5
5
.III.研究表明,对于中心离子为Hg+等阳离子的配合物,若配位体给出电子能力越强:则配位体与中心离子形成的配位键就越强,配合物也就越稳定.
(5)预测HgCl24与HgI2-4的稳定性强弱,并从元素电负性的角度加以解释.
答:HgCl2-4比HgI2-4更
不稳定
不稳定
(填“稳定”或“不稳定”),因为Cl比I电负性强,给出电子能力较弱,形成配位键较弱,配合物不稳定
Cl比I电负性强,给出电子能力较弱,形成配位键较弱,配合物不稳定
.