网址:http://m.1010jiajiao.com/timu_id_495369[举报]
6、B 7、C 8、A 9、D 10、B 11、D 12、A 13、C
26 . ( 13 分) ( 1 ) y的电子式:  ( 2 分) 非极性( l 分)
( 2 分) 非极性( l 分)
( 2 ) 87 ( l 分)
( 3 ) C ( 1 分)
( 4 )碱( 1 分) NH3?H2O  NH4+ + OH一(2分)
NH4+ + OH一(2分)
CO32― + H2O  HCO3― + OH一( 2 分)
HCO3― + OH一( 2 分)
( 5 ) 2NH3 一 6e一+ 6OH― == N2 + 6H2O ( 2 分) 减小( 1 分)
27 . ( 16 分)

( 2 ) ① ⑥ (各 1 分,共 2 分。答 ③ 不扣分,其余有错扣 1 分)
( 3 )羟基( l 分)羧基( 1 分)


28 . ( 16 分) ( 1 ) FeS2 ( 2 分) 沸腾炉(1分)
( 2 )氯酸钾(或KClO3)( 1 分) 镁条(或 Mg ) ( 1 分)

防止产生的Cl2和H2混和发生爆炸( l 分),避免Cl2和NaOH反应,使生成的 NaOH不纯( 1 分)
( 4 ) 6Fe2+ +3ClO一+ 3 H2O == 2Fe(OH)3↓+3Cl―+ 4Fe3 + ( 2分)
( 5 ) I.不合理( 1 分),因为 SO2Cl2为液体,移走 SO2Cl2对反应体系中压强和气体浓度的影响不大(或对反应速率和 SO2Cl2的产率影响不大) ( l 分)
II.不合理( 1 分),该反应为放热反应,升高温度会降低 SO2Cl2的产率,但温度过低,反应速率很小,经济效益较低。因此,应选择适当的温度。( 2 分)
29.( 15 分)
( 1 )增大铜粉与氧接触面积, 使反应迅速、充分( 2 分)
( 2 ) N2 ( 1 分),排出 D中的空气(1分) 关闭 k3( 1 分) 打开 kl、 k2 ( 1 分)
( 3 ) 锥形瓶中玻璃管液面上升( 1 分)
( 4 )Cu 十2NO3―+ 4H + === Cu 2+ + 2NO2↑+ 2H2O ( 2 分)
( 5 ) 向下调节量气管(或及时关闭 k3 ) ( 1分,其它合理答案也可给分)
( 6 ) I . 0.0720 mol / L ( 2 分)
II.有( 1 分) E 装置中生成 100 mL 、0.0720 mol / L硝酸时产生的NO 约为 80.6mL, 而试管中原有 50 mL N2,二者之和小于139.00 mL ,说明生成 NO2 的同时有 NO 生成( 2 分)。
(16分)Fenton法常用于处理含难降解有机物的工业废水。通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,试探究有关因素对该降解反应速率的影响。实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表)设计如下对比实验。
(1)请完成以下实验设计表(将表中序号处应填内容)。
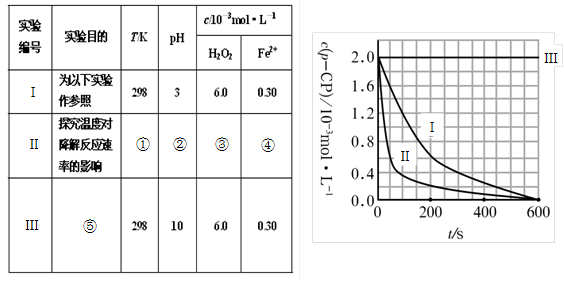
① ② ③ ④
⑤
(2)实验测得p-CP的浓度随时间变化的关系如右上图所示。
a.请根据右上图实验Ⅰ曲线,计算降解反应在50—300s内的平均反应速率v(p-CP)= ,以及300s时p-CP的降解率为 ;
b.实验Ⅰ、Ⅱ表明温度升高,降解反应速率 (填“增大”、“减小”或“不变”);
c.实验Ⅲ得出的结论是:pH=10时, ;
(3)可通过反应Fe3++ SCN— Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)=0.04 mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K= 。
查看习题详情和答案>>
(16分)Fenton法常用于处理含难降解有机物的工业废水。通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,试探究有关因素对该降解反应速率的影响。实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表)设计如下对比实验。
(1)请完成以下实验设计表(将表中序号处应填内容)。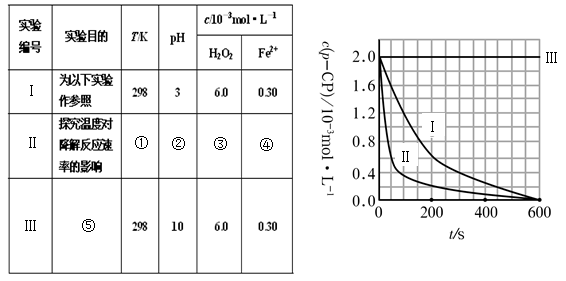
① ② ③ ④
⑤
(2)实验测得p-CP的浓度随时间变化的关系如右上图所示。
a.请根据右上图实验Ⅰ曲线,计算降解反应在50—300s内的平均反应速率v(p-CP)= ,以及300s时p-CP的降解率为 ;
b.实验Ⅰ、Ⅱ表明温度升高,降解反应速率 (填“增大”、“减小”或“不变”);
c.实验Ⅲ得出的结论是:pH=10时, ;
(3)可通过反应Fe3+ + SCN— Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)="0.04" mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K= 。
Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)="0.04" mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K= 。
(16分)Fenton法常用于处理含难降解有机物的工业废水。通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,试探究有关因素对该降解反应速率的影响。实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表)设计如下对比实验。
(1)请完成以下实验设计表(将表中序号处应填内容)。
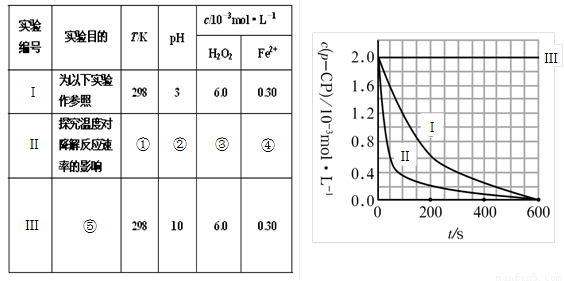
① ② ③ ④
⑤
(2)实验测得p-CP的浓度随时间变化的关系如右上图所示。
a.请根据右上图实验Ⅰ曲线,计算降解反应在50—300s内的平均反应速率v(p-CP)= ,以及300s时p-CP的降解率为 ;
b.实验Ⅰ、Ⅱ表明温度升高,降解反应速率 (填“增大”、“减小”或“不变”);
c.实验Ⅲ得出的结论是:pH=10时, ;
(3)可通过反应Fe3+
+ SCN—  Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)=0.04 mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K= 。
Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)=0.04 mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K= 。
查看习题详情和答案>>
(1)请完成以下实验设计表(将表中序号处应填内容)。

① ② ③ ④
⑤
(2)实验测得p-CP的浓度随时间变化的关系如右上图所示。
a.请根据右上图实验Ⅰ曲线,计算降解反应在50—300s内的平均反应速率v(p-CP)= ,以及300s时p-CP的降解率为 ;
b.实验Ⅰ、Ⅱ表明温度升高,降解反应速率 (填“增大”、“减小”或“不变”);
c.实验Ⅲ得出的结论是:pH=10时, ;
(3)可通过反应Fe3+ + SCN—
 Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)="0.04" mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K= 。
Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)="0.04" mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K= 。根据反应框图填空,已知反应①~⑤均为工业生产及应用中常见反应,其中B、G、I、J、L均为常见单质,B、D、J、L为气体。A是工业生产F的重要矿石原料的主要成份,其相对分子质量为120,M为海水中含量最多的无机盐。

(1)I元素在元素周期表中的位置 ;M中阴离子的结构示意图: 。
(2)固体A中所包含的化学键与固体Na2O2类似,则A的电子式为 。
(3)写出下列化学反应的离子方程式:
① 溶液P与KSCN溶液:_____________________________________ ___;
② G与N的反应:______________________________________ __________;
③ K与L的反应:___________________________________ _____________。
(4)已知每生成16 gD,放出106.5 kJ热量,则反应①的热化学方程式为:
查看习题详情和答案>>