题目内容
(16分)Fenton法常用于处理含难降解有机物的工业废水。通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,试探究有关因素对该降解反应速率的影响。实验中控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表)设计如下对比实验。
(1)请完成以下实验设计表(将表中序号处应填内容)。

① ② ③ ④
⑤
(2)实验测得p-CP的浓度随时间变化的关系如右上图所示。
a.请根据右上图实验Ⅰ曲线,计算降解反应在50—300s内的平均反应速率v(p-CP)= ,以及300s时p-CP的降解率为 ;
b.实验Ⅰ、Ⅱ表明温度升高,降解反应速率 (填“增大”、“减小”或“不变”);
c.实验Ⅲ得出的结论是:pH=10时, ;
(3)可通过反应Fe3+ + SCN— Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)="0.04" mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K= 。
Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)="0.04" mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K= 。
(1)请完成以下实验设计表(将表中序号处应填内容)。

① ② ③ ④
⑤
(2)实验测得p-CP的浓度随时间变化的关系如右上图所示。
a.请根据右上图实验Ⅰ曲线,计算降解反应在50—300s内的平均反应速率v(p-CP)= ,以及300s时p-CP的降解率为 ;
b.实验Ⅰ、Ⅱ表明温度升高,降解反应速率 (填“增大”、“减小”或“不变”);
c.实验Ⅲ得出的结论是:pH=10时, ;
(3)可通过反应Fe3+ + SCN—
 Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)="0.04" mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K= 。
Fe(SCN)2+ 来检验反应是否产生铁离子。已知在一定温度下该反应达到平衡时c(Fe3+)="0.04" mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,则此温度下该反应的平衡常数K= 。(1)① 313 ② 3 ③ 6.0 ④ 0.30 (各1分)
(以下每空2分)
⑤ 探究pH对降解速率的影响
(2)4.8×10-6 mol/(L·s) (若数值正确,不写单位或单位错误给1分)
80%(或0.8) 增大 降解速率为0
(3) 170 L/mol 或170 (mol/L)-1 (只要数值正确,写不写单位均给满分)
(以下每空2分)
⑤ 探究pH对降解速率的影响
(2)4.8×10-6 mol/(L·s) (若数值正确,不写单位或单位错误给1分)
80%(或0.8) 增大 降解速率为0
(3) 170 L/mol 或170 (mol/L)-1 (只要数值正确,写不写单位均给满分)
(1)对比实验的基本思想是控制变量法,可以在温度相同时,变化浓度,或者在浓度相等时,变化温度;
(2)a、根据反应速率公式v=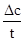 ,,降解率=
,,降解率= ×100%来计算;
×100%来计算;
b、根据实验①②的数据来回答;
c、在pH=10时,根据降解率= ×100%来计算;
×100%来计算;
(3)反应Fe3++SCN- Fe(SCN)2+的平衡常数K=
Fe(SCN)2+的平衡常数K=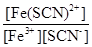 来计算。
来计算。
解;(1)对比实验的基本思想是控制变量法,温度相同时,变化浓度,在浓度相等时,变化温度,故答案为:313;3;6.0;0.30;探究pH对降解速率的影响;
(2)a.应在50-300s内的平均反应速率v(p-CP)=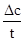 =
= =
=
4.8×10-6 mol?L-1?s-1,300s时p-CP的降解率=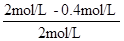 ×100%=80%,故答案为:4.8×10-6mol?L-1?s-1;80%;
×100%=80%,故答案为:4.8×10-6mol?L-1?s-1;80%;
b.根据实验数据内容可以看出温度升高,降解反应速率增大,故答案为:增大;
c.根据实验数据内容可以看出pH=10时,降解速率为零,故答案为:零;
(3)反应Fe3++SCN- Fe(SCN)2+的平衡常数K=
Fe(SCN)2+的平衡常数K=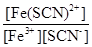 =
=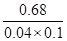 =170L/mol。
=170L/mol。
故答案为170。
(2)a、根据反应速率公式v=
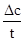 ,,降解率=
,,降解率= ×100%来计算;
×100%来计算;b、根据实验①②的数据来回答;
c、在pH=10时,根据降解率=
 ×100%来计算;
×100%来计算;(3)反应Fe3++SCN-
 Fe(SCN)2+的平衡常数K=
Fe(SCN)2+的平衡常数K=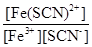 来计算。
来计算。解;(1)对比实验的基本思想是控制变量法,温度相同时,变化浓度,在浓度相等时,变化温度,故答案为:313;3;6.0;0.30;探究pH对降解速率的影响;
(2)a.应在50-300s内的平均反应速率v(p-CP)=
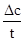 =
= =
=4.8×10-6 mol?L-1?s-1,300s时p-CP的降解率=
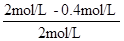 ×100%=80%,故答案为:4.8×10-6mol?L-1?s-1;80%;
×100%=80%,故答案为:4.8×10-6mol?L-1?s-1;80%;b.根据实验数据内容可以看出温度升高,降解反应速率增大,故答案为:增大;
c.根据实验数据内容可以看出pH=10时,降解速率为零,故答案为:零;
(3)反应Fe3++SCN-
 Fe(SCN)2+的平衡常数K=
Fe(SCN)2+的平衡常数K=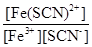 =
=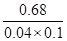 =170L/mol。
=170L/mol。故答案为170。

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
 2C (g) 。若经2s后测得C的浓度为 0.6mol/L ,下列说法正确的是
2C (g) 。若经2s后测得C的浓度为 0.6mol/L ,下列说法正确的是
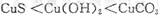
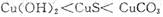

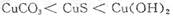
 4Y g)+Z g);△H<0,在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是( )
4Y g)+Z g);△H<0,在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是( )
 3Z(g)+2W(g),该X、Y的初始浓度分别为3.0 mol·L-1和1.0 mol·L-1,达平衡后,测出下列各生成物的浓度数据中肯定错误的是 ( )
3Z(g)+2W(g),该X、Y的初始浓度分别为3.0 mol·L-1和1.0 mol·L-1,达平衡后,测出下列各生成物的浓度数据中肯定错误的是 ( )  C(g) +3D(g) △H<0。该可逆反应的反应速率—时间、转化率—时间关系图如下,下列分析中错误的是( )
C(g) +3D(g) △H<0。该可逆反应的反应速率—时间、转化率—时间关系图如下,下列分析中错误的是( )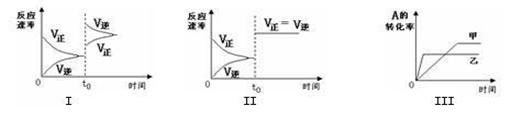
 鸡没有汗腺,在夏天只能依赖喘息调节体温。鸡过度呼出CO2,会使下列平衡向左移动,导致蛋壳变薄,使农场主和超市蒙受经济损失。
鸡没有汗腺,在夏天只能依赖喘息调节体温。鸡过度呼出CO2,会使下列平衡向左移动,导致蛋壳变薄,使农场主和超市蒙受经济损失。 (aq)
(aq) 
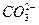 (aq)
(aq) 压下一个化学反应生成物气体的体积等于反应物气体的体积就可以粗略认为该反应的熵变为0。某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。所查资料如下:
压下一个化学反应生成物气体的体积等于反应物气体的体积就可以粗略认为该反应的熵变为0。某化学兴趣小组,专门研究了氧族元素及其某些化合物的部分性质。所查资料如下: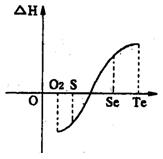
 _____
_____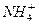 +
+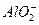 +2H2O
+2H2O Al(OH)3↓ +NH3·H2O,向含有等物质的量的
Al(OH)3↓ +NH3·H2O,向含有等物质的量的 2HI(g);△H<0。 并达平衡。HI的体积分数HI%随时问变化曲线如图2所示:
2HI(g);△H<0。 并达平衡。HI的体积分数HI%随时问变化曲线如图2所示: