网址:http://m.1010jiajiao.com/timu_id_48856[举报]
(9分)(1)常温下,有0.1mol/L的氨水和0.1mol/L的氢氧化钠溶液,回答下列问题:
①pH 值:氨水 氢氧化钠(填“<” 、“="”" 或 “>”)
②两种碱溶液均能与盐酸反应生成盐,等体积的上述两溶液与等浓度的盐酸溶液恰好反应呈中性, 消耗的盐酸多。反应生成的氯化铵溶液呈 (填“酸性” 、“中性” 或 “碱性”),其原因是(用离子方程式表示)
③向氨水溶液中加入一定量的盐酸溶液,当测得溶液的pH=7时,溶液中离子的浓度大小为
(选填字母,下同),当测得溶液的pH>7时,溶液中离子的浓度大小为 。
a.c(NH4+)>c(Cl—)>c(OH—)>c(H+) b.c(NH4+) = c(Cl—)>c(OH—) =c(H+)
c.c(Cl—)>c(NH4+)>c(H+)>c(OH—) d.c(NH4+)>c(Cl—)>c(H+)>c(OH—)
(2)向盛有1mL0.1mol/LMgCl2溶液的试管中滴加2滴2mol/L KOH溶液,有白色沉淀生成,再滴加2滴0.1mol/L FeCl3溶液,静置。可以观察到的现象是 ,产生该现象的原因是(用离子方程式和简要文字表达)
(9分)(1)常温下,有0.1mol/L的氨水和0.1mol/L的氢氧化钠溶液,回答下列问题:
①pH 值:氨水 氢氧化钠(填“<” 、“=” 或 “>”)
②两种碱溶液均能与盐酸反应生成盐,等体积的上述两溶液与等浓度的盐酸溶液恰好反应呈中性, 消耗的盐酸多。反应生成的氯化铵溶液呈 (填“酸性” 、“中性” 或 “碱性”),其原因是(用离子方程式表示)
③向氨水溶液中加入一定量的盐酸溶液,当测得溶液的pH=7时,溶液中离子的浓度大小为
(选填字母,下同),当测得溶液的pH>7时,溶液中离子的浓度大小为 。
a.c(NH4+)>c(Cl—)>c(OH—)>c(H+) b.c(NH4+) = c(Cl—)>c(OH—) =c(H+)
c.c(Cl—)>c(NH4+)>c(H+)>c(OH—) d.c(NH4+)>c(Cl—)>c(H+)>c(OH—)
(2)向盛有1mL0.1mol/LMgCl2溶液的试管中滴加2滴2mol/L KOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到的现象是 ,产生该现象的原因是(用离子方程式和简要文字表达)
查看习题详情和答案>>
(9分)(1)常温下,有0.1mol/L的氨水和0.1mol/L的氢氧化钠溶液,回答下列问题:
①pH 值:氨水 氢氧化钠(填“<” 、“=” 或 “>”)
②两种碱溶液均能与盐酸反应生成盐,等体积的上述两溶液与等浓度的盐酸溶液恰好反应呈中性, 消耗的盐酸多。反应生成的氯化铵溶液呈 (填“酸性” 、“中性” 或 “碱性”),其原因是(用离子方程式表示)
③向氨水溶液中加入一定量的盐酸溶液,当测得溶液的pH=7时,溶液中离子的浓度大小为
(选填字母,下同),当测得溶液的pH>7时,溶液中离子的浓度大小为 。
a.c(NH4+)>c(Cl—)>c(OH—)>c(H+) b.c(NH4+) = c(Cl—)>c(OH—) =c(H+)
c.c(Cl—)>c(NH4+)>c(H+)>c(OH—) d.c(NH4+)>c(Cl—)>c(H+)>c(OH—)
(2)向盛有1mL0.1mol/LMgCl2溶液的试管中滴加2滴2mol/L KOH溶液,有白色沉淀生成,再滴加2滴0.1mol/L FeCl3溶液,静置。可以观察到的现象是 ,产生该现象的原因是(用离子方程式和简要文字表达)
查看习题详情和答案>>
(9分)(1)已知25℃、101kPa时,一些物质的燃烧热为:
| 化学式 | CO(g) | H2(g) | CH3OH(l) |
| ΔH/( kJ·mol-1) | -283.0 | -285.8 | -726.5 |
②根据盖斯定律完成下列反应的热化学方程式:CO(g)+2H2(g)===CH3OH(l)ΔH=____________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
① CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1="+49.0" kJ·mol-1
② CH3OH(g)+
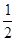 O2(g)= CO2(g)+2H2(g) △H2
O2(g)= CO2(g)+2H2(g) △H2已知H2(g)+
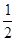 O2(g)===H2O(g) △H =" -241.8" kJ·mol-1
O2(g)===H2O(g) △H =" -241.8" kJ·mol-1则反应②的△H2= kJ·mol-1。
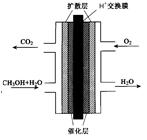
(3)甲醇燃料电池的结构示意图如下。甲醇进入 极(填“正”或“负”),正极发生的电极反应为 。
 查看习题详情和答案>>
查看习题详情和答案>>
 2C(g)
2C(g)
