题目内容
(9分)(1)常温下,有0.1mol/L的氨水和0.1mol/L的氢氧化钠溶液,回答下列问题:
①pH 值:氨水 氢氧化钠(填“<” 、“=” 或 “>”)
②两种碱溶液均能与盐酸反应生成盐,等体积的上述两溶液与等浓度的盐酸溶液恰好反应呈中性, 消耗的盐酸多。反应生成的氯化铵溶液呈 (填“酸性” 、“中性” 或 “碱性”),其原因是(用离子方程式表示)
③向氨水溶液中加入一定量的盐酸溶液,当测得溶液的pH=7时,溶液中离子的浓度大小为
(选填字母,下同),当测得溶液的pH>7时,溶液中离子的浓度大小为 。
a.c(NH4+)>c(Cl—)>c(OH—)>c(H+) b.c(NH4+) = c(Cl—)>c(OH—) =c(H+)
c.c(Cl—)>c(NH4+)>c(H+)>c(OH—) d.c(NH4+)>c(Cl—)>c(H+)>c(OH—)
(2)向盛有1mL0.1mol/LMgCl2溶液的试管中滴加2滴2mol/L KOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到的现象是 ,产生该现象的原因是(用离子方程式和简要文字表达)
(1)①< ② NaOH 酸性 NH4++H2O![]() NH3.H2O+H+ ③ b a
NH3.H2O+H+ ③ b a
(2)白色沉淀转变为红褐色 3Mg(OH)2 + 2Fe3+= 2Fe(OH)3 + 3Mg2+ ,相同条件下Fe(OH)3 溶解度小于 Mg(OH)2溶解度 ,使 Mg(OH)2溶解平衡移动,生成更难溶Fe(OH)3。
解析:(1)氨水是弱碱,氢氧化钠是强碱,在浓度相等的条件下,氨水的碱性弱于氢氧化钠的。和盐酸恰好反应后生成的氯化铵水解显酸性,而氯化钠不水解,显中性。溶液的pH=7,则c(OH—)=c(H+),根据电荷守恒c(NH4+)+ c(H+)= c(Cl—)+c(OH—)可知c(NH4+) = c(Cl—),即选项b正确。若溶液的pH>7,则c(OH—) >c(H+),选项a正确。
(2)因为氢氧化镁的溶解度大于氢氧化铁的,根据沉淀转化的原理可知,氢氧化镁将转化为更难溶的氢氧化铁。

(14分)
Ⅰ.(1)分析下表中各项的排布规律,按此规律排布第22项应为 。
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
C2H4 |
C2H6 |
C2H6O |
C2H4O2 |
C3H6 |
C3H8 |
C3H8O |
C3H6O2 |
C4H8 |
C4H10 |
(2)下列反应中属于取代反应的是 。(填序号)
①乙烯使酸性高锰酸钾溶液褪色 ②甲烷和氯气混合光照 ③苯使溴水层褪色
④乙酸和乙醇反应 ⑤乙醇变成乙醛 ⑥葡萄糖发生银镜反应
Ⅱ.A、B、C、D、E、F为原子序数依次增大的六种短周期元素。常温下,六种元素的常见单质中三种为气体,三种为固体。A与E,D与F分别同主族,A能与B、C、D分别形成电子数相等的三种分子,C、D的最外层电子数之和与E的核外电子总数相等。试回答下列问题:
(1)写出下列元素的元素符号: C ,F 。
(2)分子式为A2B2D4的化合物与含等物质的量的KOH的溶液反应后所得溶液呈酸性,其原因是 。(用方程式及必要的文字说明)。该溶液中各离子浓度由大到小的顺序为 。
(3)由A、C、D、F和Fe五种元素可组成类似明矾的化合物Z(相对分子质量为392),1molZ中含有6mol结晶水。对化合物Z进行如下实验:
a.取Z的溶液,加入过量的NaOH浓溶液并加热,产生白色沉淀和无色有刺激性气味的气体。白色沉淀迅速变为灰绿色,最终变为红褐色;
b.另取Z的溶液,加入过量的BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
①Z的化学式为 。
②已知100mL1mol/LZ溶液能与20mL1mol/LKMnO4溶液(硫酸酸化)恰好反应,写出该反应的离子方程式 。
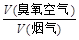 流量比为y,请通过计算列出y与x的关系式。
流量比为y,请通过计算列出y与x的关系式。 流量比为y,请通过计算列出y与x的关系式。
流量比为y,请通过计算列出y与x的关系式。