网址:http://m.1010jiajiao.com/timu_id_457590[举报]
一、选择题(每小题4分,共60分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
答案
D
D
B
C
C
B
A
C
D
C
C
B
D
B
A
二、选择题(每小题4分,选对但不全得2分,共28分)
题号
16
17
18
19
20
21
22
答案
AC
BCD
BD
A
AD
D
BCD
23.(1)①较大(2分) ②30 (2分)
(2)①
.files\image337.jpg)
③.files\image339.gif) (2分)
(2分)
24.(16分)解:
(1)小球恰能在A点沿轨道运动时:
.files\image341.gif) (2分)
(2分)
此时,小球在.files\image191.gif) 点动能最小,由机械能守恒:
点动能最小,由机械能守恒:
.files\image344.gif) (2分)
(2分)
解得:
.files\image346.gif) (1分)
(1分)
(2)在.files\image191.gif) 点:
点:.files\image349.gif) (2分)
(2分)
在.files\image193.gif) 点:
点:.files\image352.gif) (2分)
(2分)
小球从A到B机械能守恒:
.files\image354.gif) (2分)
(2分)
两点的压力差:.files\image356.gif) (1分)
(1分)
(3)由图象知:
截距:.files\image358.gif)
.files\image360.gif) (2分)
(2分)
斜率:.files\image362.gif)
.files\image364.gif) (2分)
(2分)
25.(18分)解:
(1)当线框下降.files\image176.gif) 过程中,对线框和物快组成的整体,由动能定理得
过程中,对线框和物快组成的整体,由动能定理得.files\image367.gif) (3分)
(3分)
.files\image369.gif) (2分)
(2分)
(2)线框以I区进入Ⅱ区过程中
.files\image371.gif) (2分)
(2分)
.files\image373.gif)
.files\image375.gif) (3分)
(3分)
(3)线框.files\image218.gif) 边运动到
边运动到.files\image240.gif) 位置之前,只有
位置之前,只有.files\image218.gif) 边从
边从.files\image226.gif) 位置下降2
位置下降2.files\image176.gif) 的过程产生感应电流,设线框
的过程产生感应电流,设线框.files\image218.gif) 边在Ⅱ区域匀速运动的速度是
边在Ⅱ区域匀速运动的速度是.files\image383.gif) ,线圈中电流为
,线圈中电流为.files\image385.gif) ,则
,则
.files\image387.gif) (1分)
(1分)
此时.files\image389.gif) 均做匀速运动
均做匀速运动
.files\image391.gif) (1分)
(1分)
.files\image393.gif) (2分)
(2分)
根据能量转化与守恒定律
.files\image395.gif) (3分)
(3分)
或.files\image397.gif)
.files\image399.gif) (1分)
(1分)
26.(15分)
(1)①
.files\image401.jpg)
②常染色体上的显性遗传(2分) AA或Aa(1分)
.files\image403.gif) (2分)
(2分)
③G-C突变成A-T(2分) 减少(1分)
(2)①父亲的21号染色体在减数第一次分裂中未发生正常分离或在减数第二次分裂中没有分别移向两极(2分)
②适龄生育和产前胎儿细胞的染色体分析(1分)
(3)人体患病也是人体所表现出来的性状,而性状是由基因控制的,所以说疾病都是
基因病,是有一定道理的;然而,这种观点过于绝对化,人类的疾病并不都是由基因的缺陷或改变引起的,也可能是外界环境因素造成的,如由大肠杆菌引起的腹泻,就不是基因病。 (2分)
27.(18分)
(1)①光反应(1分) 色素的数量(1分)
.files\image405.gif) (1分) 光照强度(1分)
(1分) 光照强度(1分)
②白天增加光照强度和夜间适当减低温室内的温度(2分) 因为在该光照强度以下增加光照强度可提高光合作用强度;低温时呼吸速率低(2分)
(2)(2分)
.files\image407.jpg)
(3)植株过密,叶片接受光照不足、通风不良,影响叶绿体进行光合作用;植株过密,单位空间中的线粒体多,细胞呼吸强度增加.结果造成小麦果实中积累的有机物不增加或增加很、或减少.(2分)
(4)步骤一:将提取的完整线粒体和叶绿体悬浮液,分别加入盛有丙铜溶液和.files\image253.gif) 溶液的两支大小相同编号为1、2的试管中,经予充足光照.(2分)
溶液的两支大小相同编号为1、2的试管中,经予充足光照.(2分)
步骤二:分别用澄清的石灰水和点燃的卫生香检验1号和2号试管中产生的气体(2分)
实验现象:1号试管产生的气体使澄清的石灰水变浑浊,2号试管产生的气体使点燃的卫生香燃烧更猛烈(1分)
实验结论:线粒体内发生细胞呼吸过程产生.files\image011.gif) ,叶绿体内发生光合作用产生
,叶绿体内发生光合作用产生.files\image053.gif) 。(1分)
。(1分)
28.(13分)
(1).files\image412.jpg) (2分)
(2分)
(2).files\image414.jpg) (2分)
(2分)
(3).files\image416.gif) (2分)
(2分)
(4).files\image418.gif) (2分)
(2分)
(5).files\image270.gif) (2分) 大于(2分)
(2分) 大于(2分)
29.(16分)
(1)烧杯、漏斗、玻璃棒(2分)
(2)①.files\image421.gif) (2分)
(2分)
②.files\image423.gif) (2分)
(2分)
(3)取少量滤液D加入.files\image063.gif) 溶液,产生白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色(2分,其他合理答案同样得分)
溶液,产生白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色(2分,其他合理答案同样得分)
(4).files\image426.gif)
或.files\image428.gif) (3分)
(3分)
(5).files\image430.gif) (3分)
(3分)
30.(13分)
(3).files\image432.gif) (2分)
(2分)
(5)反应后的气体中碳、氧原子的物质的量之比为2:3,与二氧化碳种碳、氧原子的物质的量比不相符(3分)
(6)CO和CO.files\image005.gif) (2分)
(2分) .files\image435.gif) (3分)
(3分)
(7)在原装置最后连接上C装置(3分)
【选做部分】
31.(8分)[化学――化学与技术]
(1).files\image437.gif) (2分)
(2分)
(2)C (1分)
(3)AB(2分)
(4)氨水 (1分)
.files\image439.gif) (写
(写.files\image441.gif) 也可)(2分)
也可)(2分)
32.(8分)[化学――物质结构与性质]
(1).files\image443.gif) (2分)
(2分)
(2)F>N>0(1分)
(3)2(1分)
(4)原子(1分)大 (1分)
(5)HF分子之间可以形成氢键从而使熔沸点升高。(2分)
33.(8分)[化学――有机化学基础]
(1).files\image445.gif) (2分)
(2分)
(2).files\image447.jpg)
(3)消去反应(1分) 氧化反应(1分)
(4).files\image449.jpg) (2分)
(2分)
34.(8分)[生物技术实践]
(1)蛋白酶 蛋白酶和脂肪酶 加酶和适当提高温度 没有差异,因为高温使酶失活
(2)固定话酶 (3)平板划线法(或稀释涂布平板法) 纤维素
(4)萃取法、蒸馏法、压榨法(任选两种)
35.(8分)[现代生物科技]
(1)限制酶、NDA连接酶 基因重组或重组DNA
(2)第一步 从转基因棉花细胞内提取 mRNA,用标记的目的基因作探针与mR-NA杂交,如果显示出杂交带,则表明目的基因转录出了mRNA。
(3)脱分化 愈伤组织 胚状体、不定芽、顶芽和腑芽等
(4)将目的基因导入叶绿体基因组或线粒体基因组中
36.(8分)(1)A(2分) (2)吸收(3分)
(3).files\image451.gif) (3分)
(3分)
37.(8分)(1)1,沿.files\image188.gif) 轴负方向 (2)
轴负方向 (2).files\image454.gif) ,15(每空2分)
,15(每空2分)
38.(8分)(1)BC (2).files\image456.gif) (每空4分)
(每空4分)
(16分)氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活中的事例中没有发生氧化还原反应的是________。
| A.煤的形成 | B.原电池工作 |
| C.简单机械织布 | D.我国古代烧制陶器 |
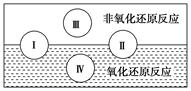
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:_________________________,其中水为________剂。
(3)氯化铵常用于焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:
________CuO+________NH4Cl
 ________Cu+______CuCl2+______ N2↑+______H2O。
________Cu+______CuCl2+______ N2↑+______H2O。①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是________(填元素名称),氧化剂是________(填化学式)。
③反应中若产生0.2 mol的气体,则有________ mol的电子转移。 查看习题详情和答案>>
氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
(1)Al与NaOH溶液反应的离子方程式为???????????????????????????????????? 。
(2)下列实验能比较镁和铝的金属性强弱的是???? ??? ?? (填序号)。
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1 mol/LAlCl3和0.1 mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一。
已知:4Al (s)+3O2(g) =2Al2O3(s)??? ΔH1 = -3352 kJ/mol
Mn(s)+ O2(g) =MnO2 (s)???? ΔH2 = -521 kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是?????????????????????? ????? 。
(4)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,其反应方程式为??????????????????? ????????? ???????????? 。
(5)工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g) + 2N2(g) + 6H2(g)  Si3N4(s) + 12HCl(g)?? △H<0??
Si3N4(s) + 12HCl(g)?? △H<0??
某温度和压强条件下,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g。
①H2的平均反应速率是???????? mol/(L·min)。
②若按n(SiCl4) : n(N2) : n(H2) = 3 : 2 : 6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应????? (填“增大”、“减小”或“不变”)。
(6)298K时,Ksp[Ce(OH)4]=1×10—29。Ce(OH)4的溶度积表达式为Ksp=?????????????? 。
为了使溶液中Ce4+沉淀完全,即残留在溶液中的c(Ce4+)小于1×10-5mol·L-1,需调节pH为????? 以上。
查看习题详情和答案>>
氧化还原反应在生产、生活中具有广泛用途,贯穿古今。
(1)下列生产、生活中的事例中有发生氧化还原反应的是 。(有两个正确选项)
A.古代活字印刷 B.原电池工作 C.简单机械织布 D.我国古代湿法炼铜
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。

试写出有水参加的符合反应类型Ⅳ的一个化学方程式: 其中水为 剂。
(3)氯化铵常用于焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为: CuO+ NH4Cl = Cu+ CuCl2+ N2+ H2O
①配平此氧化还原反应方程式
②该反应中,被氧化的元素是 (填元素名称),氧化剂是 (填化学式)
③反应中若产生0.2mol的气体,则有 个电子转移。
查看习题详情和答案>>
氧化还原反应在生产、生活中具有广泛用途,贯穿古今。
(1)下列生产、生活中的事例中有发生氧化还原反应的是 。(有两个正确选项)
| A.古代活字印刷 | B.原电池工作 | C.简单机械织布 | D.我国古代湿法炼铜 |
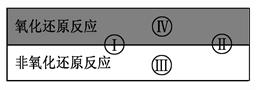
试写出有水参加的符合反应类型Ⅳ的一个化学方程式: 其中水为 剂。
(3)氯化铵常用于焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为: CuO+ NH4Cl = Cu+ CuCl2+ N2+ H2O
①配平此氧化还原反应方程式
②该反应中,被氧化的元素是 (填元素名称),氧化剂是 (填化学式)
③反应中若产生0.2mol的气体,则有 个电子转移。 查看习题详情和答案>>
氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
(1)Al与NaOH溶液反应的离子方程式为 。
(2)下列实验能比较镁和铝的金属性强弱的是 (填序号)。
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1 mol/LAlCl3和0.1 mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一。
已知:4Al (s)+3O2(g) =2Al2O3(s) ΔH1 =" -3352" kJ/mol
Mn(s)+ O2(g) =MnO2 (s) ΔH2 =" -521" kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是 。
(4)氮化硅抗腐蚀能力很强,但易被氢氟酸腐蚀,氮化硅与氢氟酸反应生成四氟化硅和一种铵盐,其反应方程式为 。
(5)工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g) + 2N2(g) + 6H2(g) Si3N4(s) + 12HCl(g) △H<0
Si3N4(s) + 12HCl(g) △H<0
某温度和压强条件下,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g。
①H2的平均反应速率是 mol/(L·min)。
②若按n(SiCl4) : n(N2) : n(H2) =" 3" : 2 : 6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应 (填“增大”、“减小”或“不变”)。
(6)298K时,Ksp[Ce(OH)4]=1×10—29。Ce(OH)4的溶度积表达式为Ksp= 。
为了使溶液中Ce4+沉淀完全,即残留在溶液中的c(Ce4+)小于1×10-5mol·L-1,需调节pH为 以上。