摘要:A. 0.3 mol B. 0.15 mol
网址:http://m.1010jiajiao.com/timu_id_453354[举报]
将0.15 mol Fe3O4完全溶解在足量稀硫酸中,然后加入K2Cr2O7溶液250 mL,恰好使溶液中Fe2+全部氧化成Fe3+,Cr2O72-全部转化成Cr3+,则K2Cr2O7溶液的物质的量浓度是
A.0.05 mol/L B.0.1 mol/L C.0.2 mol/L D.0.3 mol/L
查看习题详情和答案>>
0.15 mol烃A,在完全燃烧后生成CO2 13.44 L(标况),等质量的A能跟0.3 molH2加成,则A的结构式可能是
A、CH2
= CH—CH2—CH3
B、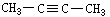
C、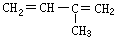 D、
D、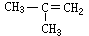
查看习题详情和答案>>
0.15 mol烃A,在完全燃烧后生成CO2 13.44 L(标况),等质量的A能跟0.3 molH2加成,则A的结构式可能是
A、CH2= CH—CH2—CH3 B、
C、 D、
查看习题详情和答案>>
将0.15 mol Fe3O4完全溶解在足量稀硫酸中,然后加入K2Cr2O7溶液250 mL,恰好使溶液中Fe2+全部氧化成Fe3+,Cr2O72-全部转化成Cr3+,则K2Cr2O7溶液的物质的量浓度是
A.0.05 mol/L B.0.1 mol/L C.0.2 mol/L D.0.3 mol/L
查看习题详情和答案>>A、B、C、D四种短周期元素的原子序数依次增大,A元素的气态氢化物与A元素的最高价氧化物对应的水化物能反应生成盐;B、C、D同周期,它们的最高价氧化物对应的水化物两两之间都能反应生成盐和水,B和D可组成化合物BD,回答下列问题.
(1)B的最高价氧化物对应的水化物与C的氧化物在溶液中反应的离子方程式为:
(2)B、D的最高价氧化物对应的水化物在稀溶液中反应,若生成0.25mol水时放出Q kJ的热量,则该反应的热化学方程式为
(3)在BHCO3的水溶液中,c(B+)-c(H2CO3)=
(4)在一定条件下,将2molA2和3molH2在一固定体积的密闭容器中反应达到平衡状态,此时容器中混合气体的平均相对分子质量为15.5,则H2的转化率为
查看习题详情和答案>>
(1)B的最高价氧化物对应的水化物与C的氧化物在溶液中反应的离子方程式为:
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
.(2)B、D的最高价氧化物对应的水化物在稀溶液中反应,若生成0.25mol水时放出Q kJ的热量,则该反应的热化学方程式为
NaOH(aq)+HClO4(aq)=NaClO4(aq)+H2O(l)△H=-4QKJ/mol
NaOH(aq)+HClO4(aq)=NaClO4(aq)+H2O(l)△H=-4QKJ/mol
.(3)在BHCO3的水溶液中,c(B+)-c(H2CO3)=
c(Na+)-c(H2CO3)=C(HCO3-)+C(CO32-)
c(Na+)-c(H2CO3)=C(HCO3-)+C(CO32-)
.(4)在一定条件下,将2molA2和3molH2在一固定体积的密闭容器中反应达到平衡状态,此时容器中混合气体的平均相对分子质量为15.5,则H2的转化率为
50%
50%
.若平衡后,再按n(A2):n(H2):n(AH3)=3:3:2向该密闭容器中充入气体,当重新达到平衡后,A2在平衡混合气中的百分含量较原平衡小
小
(填“大”、“小”或“不变”).