题目内容
将0.15 mol Fe3O4完全溶解在足量稀硫酸中,然后加入K2Cr2O7溶液250 mL,恰好使溶液中Fe2+全部氧化成Fe3+,Cr2O72-全部转化成Cr3+,则K2Cr2O7溶液的物质的量浓度是
A.0.05 mol/L B.0.1 mol/L C.0.2 mol/L D.0.3 mol/L
B
【解析】
试题分析:根据Fe3O4+4H2SO4=FeSO4+Fe2(SO4)233+4H2O 可知,Fe2+含有0.15mol,再根据6Fe2++14H++Cr2O72-=6Fe3+2Cr3++7H2O
, Cr2O72-需要的物质量就为0.025mol,故K2Cr2O7溶液的物质的量浓度为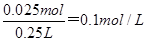 ,答案选B。
,答案选B。
考点:物质的量浓度计算
点评:本题考查物质的量浓度计算,属于易错题,计算过程应注意化学方程式的书写。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
图1-13
请填写下列空白:
(1)E物质的分子式为_________________。
(2)当Y是__________(填名称)时,则D和H溶液中溶质(填酸、碱、盐、氧化物)属于____________类。
(3)若0.1 mol/L的H溶液,测其pH=1,使H和E按物质的量之比为1∶2的比例混合后,加入水配制V mL溶液,其pH为8.5,则溶液中离子浓度由大到小的顺序为______________。
(4)若D与(3)中的H属于同类物质,将0.15 mol/L的D溶液与pH=13的氢氧化钠溶液等体积混合,混合后溶液的pH为__________________。
(5)从影响反应速率和化学平衡的因素分析,由B生成C的反应为放热反应,其实验数据如下:
不同条件下B的转化率
| 1大气压 | 5大气压 | 10大气压 | 50大气压 | 100大气压 |
97.5 | 98.9 | 99.2 | 99.6 | 99.7 | |
85.7 | 92.9 | 94.9 | 97.7 | 98.3 |
工业生产中应选用的反应条件是__________________,原因是_________________________。
(1)将0.15 mol·L-1稀硫酸V1 mL与0.1 mol·L-1 NaOH溶液V2 mL混合,所得溶液的pH为1,则V1∶V2=________。(溶液体积变化忽略不计)
(2)室温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,根据题意,回答下列问题:
①若由0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合而得,则溶液的pH________7。
②若溶液pH>7,则c(Na+)________c(A-),理由是____________________________________。
③若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是________(填选项代号)。
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7 mol·L-1 |
| B.若V1=V2,反应后溶液的pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
(1)将0.15 mol/L稀硫酸V1 mL与0.1 mol/L NaOH溶液V2 mL混合,所得溶液的pH为1,则V1∶V2= (溶液体积变化忽略不计)
(2)常温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,根据题意,回答下列问题:
①若由0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合而得,则溶液的pH 7
②若溶液pH<7,则c(Na+) c(A-)
③若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则
下列说法正确的是 (填选项代号).
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7 mol/L |
| B.若V1=V2,反应后溶液pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |