题目内容
请回答下列问题:
(1)S单质的常见形式为S8,其环状结构如图1所示,S原子采用的轨道杂化方式是______.
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量.Mg与Al原子的第一电离能大到小的顺序为______;O与F电负性大到小的顺序为______.(用<或=或>表示)
(3)34号元素的价层电子的电子排布图为______,在周期表位于______区;Mn2+基态的电子排布式为______.
(4)气态SO2分子的立体构型为______;SO32-离子的立体构型为______(均用文字描述)
(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释;
①H2SeO4和H2SeO3第一步电离程度大于第二部电离的原因:______;
②H2SeO4比H2SeO3酸性强的原因:______;
(6)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-.不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为______.
(7)Cu元素的一种氯化物晶体的晶胞结构如图2所示,该氯化物的化学式是______.
【答案】分析:(1)由S8分子结构可知,在S8分子中S原子成键电子对数为2,孤电子对数为2,即价层电子对数为4;
(2)同周期元素随原子序数增大第一电离能增大,当能级处于半满、全面、全空是能量降低,第一电离能高于同周期相邻的元素;
同周期元素随原子序数增大电负性增强;
(3)根据核外电子排布规律规律书写Se的价层电子的电子排布图,确定在周期表位置;Mn是25号元素,根据核外电子排布规律规律书写Mn2+基态的电子排布式;
(4)计算SO2分子、SO32-离子,中心原子S原子的价层电子对数,及孤对电子对数判断;
(5)①酸第一步电离产生的酸根阴离子带有负电荷,由于异种电荷相互吸引,第一步产生的H+抑制第二步电离;
②H2SeO3的分子结构为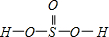 ,Se为+4价,而H2SeO4的分子结构为
,Se为+4价,而H2SeO4的分子结构为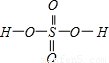 ,Se为+6价,后者Se原子吸电子能力强;
,Se为+6价,后者Se原子吸电子能力强;
(6)Cu2+与OH-形成配位键;
(7)根据均摊法计算晶胞中原子数目,据此书写化学式.
解答:解:(1)由S8分子结构可知,在S8分子中S原子成键电子对数为2,孤电子对数为2,即价层电子对数为4,因此S原子采用的杂化轨道方式为sp3,故答案为:sp3;
(2)同周期元素随原子序数增大第一电离能增大,所以Mg与Al原子的第一电离能大到小的顺序为Al>Mg;同周期元素随原子序数增大电负性增强,电负性F>O,
故答案为:Al>Mg;F>O;
(3)Se为34号元素,其核外电子排布式为1s22s22p63s23p63d104s24p4,位于周期表第四周期第ⅥA族;
Mn是25号元素,核外电子排布式为1s22s22p63s23p63d54s2,Mn2+基态的电子排布式为1s22s22p63s23p63d5,
故答案为:1s22s22p63s23p63d104s24p4;第四周期第ⅥA族;1s22s22p63s23p63d5;
(4)SO2分子中心原子S原子的价层电子对数为 =3,有1对孤对电子对,为V形;SO32-离子中心原子S原子的价层电子对数为
=3,有1对孤对电子对,为V形;SO32-离子中心原子S原子的价层电子对数为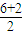 =4,有1对孤对电子对,为三角锥型,
=4,有1对孤对电子对,为三角锥型,
故答案为:V形;三角锥型;
(5)①酸第一步电离产生的酸根阴离子带有负电荷,吸引H+,同时产生的H+抑制第二步电离,所以H2SeO4和H2SeO3第一步电离程度大于第二部电离沉淀,
故答案为:酸第一步电离产生的酸根阴离子带有负电荷,吸引H+,同时产生的H+抑制第二步电离;
②H2SeO3的分子结构为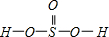 ,Se为+4价,而H2SeO4的分子结构为
,Se为+4价,而H2SeO4的分子结构为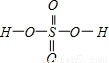 ,Se为+6价,后者Se原子吸电子能力强,则羟基上氢原子更容易电离出H+,
,Se为+6价,后者Se原子吸电子能力强,则羟基上氢原子更容易电离出H+,
故答案为:H2SeO4和H2SeO3可以分别表示为(HO)2SeO2、(HO)2SeO,H2SeO3中Se为+4价,而H2SeO4中Se为+6价,后者Se原子吸电子能力强,导致羟基上氢原子更容易电离H+;
(6)Cu2+与OH-形成配位键,[Cu(OH)4]2-的结构可用示意图表示为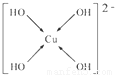 ,故答案为:
,故答案为: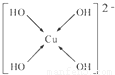 ;
;
(7)由晶胞结构可知,每个晶胞中含Cl: ×8+
×8+ ×6=4,含Cu:4,所以化学式为CuCl,故答案为:CuCl.
×6=4,含Cu:4,所以化学式为CuCl,故答案为:CuCl.
点评:本题综合考查物质结构与性质相关知识,涉及杂化轨道、第一电离能、电负性、电子排布式、分子的立体构型、晶胞的计算等,难度较大,需要学生具有扎实的基础与灵活运用的能力.
(2)同周期元素随原子序数增大第一电离能增大,当能级处于半满、全面、全空是能量降低,第一电离能高于同周期相邻的元素;
同周期元素随原子序数增大电负性增强;
(3)根据核外电子排布规律规律书写Se的价层电子的电子排布图,确定在周期表位置;Mn是25号元素,根据核外电子排布规律规律书写Mn2+基态的电子排布式;
(4)计算SO2分子、SO32-离子,中心原子S原子的价层电子对数,及孤对电子对数判断;
(5)①酸第一步电离产生的酸根阴离子带有负电荷,由于异种电荷相互吸引,第一步产生的H+抑制第二步电离;
②H2SeO3的分子结构为
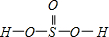 ,Se为+4价,而H2SeO4的分子结构为
,Se为+4价,而H2SeO4的分子结构为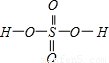 ,Se为+6价,后者Se原子吸电子能力强;
,Se为+6价,后者Se原子吸电子能力强;(6)Cu2+与OH-形成配位键;
(7)根据均摊法计算晶胞中原子数目,据此书写化学式.
解答:解:(1)由S8分子结构可知,在S8分子中S原子成键电子对数为2,孤电子对数为2,即价层电子对数为4,因此S原子采用的杂化轨道方式为sp3,故答案为:sp3;
(2)同周期元素随原子序数增大第一电离能增大,所以Mg与Al原子的第一电离能大到小的顺序为Al>Mg;同周期元素随原子序数增大电负性增强,电负性F>O,
故答案为:Al>Mg;F>O;
(3)Se为34号元素,其核外电子排布式为1s22s22p63s23p63d104s24p4,位于周期表第四周期第ⅥA族;
Mn是25号元素,核外电子排布式为1s22s22p63s23p63d54s2,Mn2+基态的电子排布式为1s22s22p63s23p63d5,
故答案为:1s22s22p63s23p63d104s24p4;第四周期第ⅥA族;1s22s22p63s23p63d5;
(4)SO2分子中心原子S原子的价层电子对数为
 =3,有1对孤对电子对,为V形;SO32-离子中心原子S原子的价层电子对数为
=3,有1对孤对电子对,为V形;SO32-离子中心原子S原子的价层电子对数为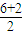 =4,有1对孤对电子对,为三角锥型,
=4,有1对孤对电子对,为三角锥型,故答案为:V形;三角锥型;
(5)①酸第一步电离产生的酸根阴离子带有负电荷,吸引H+,同时产生的H+抑制第二步电离,所以H2SeO4和H2SeO3第一步电离程度大于第二部电离沉淀,
故答案为:酸第一步电离产生的酸根阴离子带有负电荷,吸引H+,同时产生的H+抑制第二步电离;
②H2SeO3的分子结构为
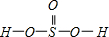 ,Se为+4价,而H2SeO4的分子结构为
,Se为+4价,而H2SeO4的分子结构为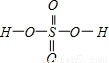 ,Se为+6价,后者Se原子吸电子能力强,则羟基上氢原子更容易电离出H+,
,Se为+6价,后者Se原子吸电子能力强,则羟基上氢原子更容易电离出H+,故答案为:H2SeO4和H2SeO3可以分别表示为(HO)2SeO2、(HO)2SeO,H2SeO3中Se为+4价,而H2SeO4中Se为+6价,后者Se原子吸电子能力强,导致羟基上氢原子更容易电离H+;
(6)Cu2+与OH-形成配位键,[Cu(OH)4]2-的结构可用示意图表示为
 ,故答案为:
,故答案为: ;
;(7)由晶胞结构可知,每个晶胞中含Cl:
 ×8+
×8+ ×6=4,含Cu:4,所以化学式为CuCl,故答案为:CuCl.
×6=4,含Cu:4,所以化学式为CuCl,故答案为:CuCl.点评:本题综合考查物质结构与性质相关知识,涉及杂化轨道、第一电离能、电负性、电子排布式、分子的立体构型、晶胞的计算等,难度较大,需要学生具有扎实的基础与灵活运用的能力.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
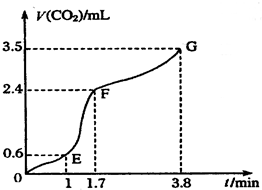 Ⅰ现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题:
Ⅰ现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题: