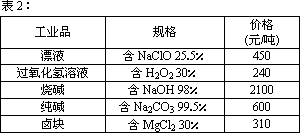
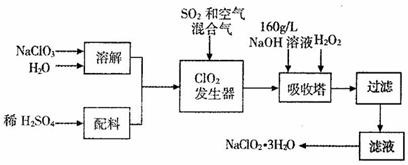
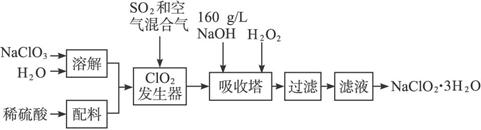
摘要:在酸性条件下.次氯酸钠.过氧化氢都有很强的氧化性.可将Fe氧化为Fe,Mg(OH)2和Fe(OH)2在溶液中生成时呈胶状物或絮状物沉淀.而MgCO3在水中煮沸可转变为 Mg(OH)2.“卤块 的主要成分为MgCl2(含有FeCl2.FeCl3.MnCl2等杂质).若以它为原料.按下图工艺流程可制得“轻质氧化镁 .要求产品不含杂质离子.而且成本较低.流程中溶液pH调节和所用试剂可参考表1.表2来确定.
网址:http://m.1010jiajiao.com/timu_id_446038[举报]
题号
1
2
3
4
5
6
7
8
答案
C
C
A
B
C
D
B
A
题号
9
10
11
12
13
14
15
16
答案
B
B
C
D
B
A
C
D



 + H2O
+ H2O  +HCl
+HCl 
 +NaCl
+NaCl


 +c(H+)×
+c(H+)× (或 R≥8.3)
(1分)
(或 R≥8.3)
(1分)