摘要:21.把一定量的Na2CO3.NaHCO3.Na2SO4混合物加到200mL 1.00mol/L的HCl中完全反应后生成2016mL干燥的CO2.然后加入400mL 0.10 mol/L的Ba(OH)2溶液.使SO42-完全沉淀.再加40 mL 1.00 mol/L的HCI恰好中和过量的碱.最后把沉淀分离出来.干燥称量为1.48g.求混合物中各组分的质量分数.
网址:http://m.1010jiajiao.com/timu_id_4459351[举报]
为测定Na2CO3和NaCl混合物中Na2CO3质量分数,甲、乙、丙三位同学分别进行如下实验,请根据实验内容回答相关问题:
(1)甲同学实验的主要步骤有:
①过滤
②加入足量的CaCl2溶液
③将沉淀小心烘干、称量,测得固体质量为ng
④称取mg样品溶于适量蒸馏水
⑤洗涤沉淀2-3次.
该同学正确的操作步骤为 (填序号);混合物中碳酸钠的质量分数为 (只需列出计算式).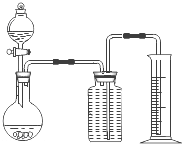
(2)乙同学把一定量的混合物与足量盐酸反应,然后用如图装置测定产生的CO2气体的体积,实验室中只有如下试剂:样品、6mol/L盐酸、Na2CO3溶液、CaCl2溶液、饱和NaHCO3溶液.
①广口瓶中盛放的溶液是 .
②该装置测定的气体体积往往不准确(不考虑导管中水的体积),理由是 .
(3)丙同学准确称取w g样品放入锥形瓶中,加入V1 mL 0.1000mol/L盐酸,充分反应,用0.1000mol/L的氢氧化钠溶液滴定过量盐酸,消耗氢氧化钠溶液V2 mL.
①实验室现有1.000mol/L盐酸溶液.为了精确配制100mL 0.1000mol/L的盐酸溶液,需要的仪器有:烧杯、100mL容量瓶、玻璃棒、胶头滴管、 .
②滴定时选择 作指示剂.
③混合物中碳酸钠的质量分数为 (只需列出计算式).
查看习题详情和答案>>
(1)甲同学实验的主要步骤有:
①过滤
②加入足量的CaCl2溶液
③将沉淀小心烘干、称量,测得固体质量为ng
④称取mg样品溶于适量蒸馏水
⑤洗涤沉淀2-3次.
该同学正确的操作步骤为

(2)乙同学把一定量的混合物与足量盐酸反应,然后用如图装置测定产生的CO2气体的体积,实验室中只有如下试剂:样品、6mol/L盐酸、Na2CO3溶液、CaCl2溶液、饱和NaHCO3溶液.
①广口瓶中盛放的溶液是
②该装置测定的气体体积往往不准确(不考虑导管中水的体积),理由是
(3)丙同学准确称取w g样品放入锥形瓶中,加入V1 mL 0.1000mol/L盐酸,充分反应,用0.1000mol/L的氢氧化钠溶液滴定过量盐酸,消耗氢氧化钠溶液V2 mL.
①实验室现有1.000mol/L盐酸溶液.为了精确配制100mL 0.1000mol/L的盐酸溶液,需要的仪器有:烧杯、100mL容量瓶、玻璃棒、胶头滴管、
②滴定时选择
③混合物中碳酸钠的质量分数为
把一定量的NaHCO3和Na2O2的混合物放在密闭容器中加热.关于混合物加热前后消耗盐酸的物质的量,下列结论判断正确的是( )
| A、加热前消耗的多 | B、加热前加热后消耗的一样多 | C、加热后消耗的多 | D、不知NaHCO3和Na2O2含量无法确定 |
把一定量的Na2O2的NaHCO3的混合粉末分为两等份,将其中一份加入100mL稀盐酸中恰好完全反应,生成的气体干燥后体积为2.24L(标准状况下);再将此气体通入另一份混合物中,充分反应后,得到O2 2.016L(标准状况下),则原混合粉末中Na2O2和NaHCO3的物质的量之比及稀盐酸的物质的量浓度是( )
|
查看习题详情和答案>>
(2012?上海模拟)把一定量的Na2O2和NaHCO3混合粉末分为两等份,将其中一份加入到100mL稀盐酸中恰好完全反应,生成干燥的气体2.24L(标准状况),再将此气体通入到另一份混合物中,充分反应后,气体减少为2.016L(标准状况),则原混合粉末中Na2O2和NaHCO3的物质的量之比及原稀盐酸的物质的量浓度可能是( )
|
查看习题详情和答案>>