题目内容
为测定Na2CO3和NaCl混合物中Na2CO3质量分数,甲、乙、丙三位同学分别进行如下实验,请根据实验内容回答相关问题:
(1)甲同学实验的主要步骤有:
①过滤
②加入足量的CaCl2溶液
③将沉淀小心烘干、称量,测得固体质量为ng
④称取mg样品溶于适量蒸馏水
⑤洗涤沉淀2-3次.
该同学正确的操作步骤为 (填序号);混合物中碳酸钠的质量分数为 (只需列出计算式).
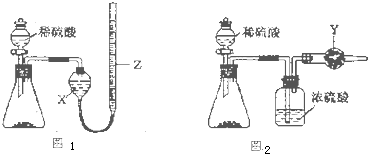
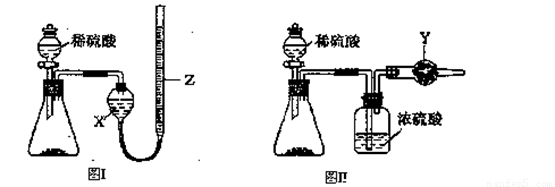
(2)乙同学把一定量的混合物与足量盐酸反应,然后用如图装置测定产生的CO2气体的体积,实验室中只有如下试剂:样品、6mol/L盐酸、Na2CO3溶液、CaCl2溶液、饱和NaHCO3溶液.
①广口瓶中盛放的溶液是 .
②该装置测定的气体体积往往不准确(不考虑导管中水的体积),理由是 .
(3)丙同学准确称取w g样品放入锥形瓶中,加入V1 mL 0.1000mol/L盐酸,充分反应,用0.1000mol/L的氢氧化钠溶液滴定过量盐酸,消耗氢氧化钠溶液V2 mL.
①实验室现有1.000mol/L盐酸溶液.为了精确配制100mL 0.1000mol/L的盐酸溶液,需要的仪器有:烧杯、100mL容量瓶、玻璃棒、胶头滴管、 .
②滴定时选择 作指示剂.
③混合物中碳酸钠的质量分数为 (只需列出计算式).
(1)甲同学实验的主要步骤有:
①过滤
②加入足量的CaCl2溶液
③将沉淀小心烘干、称量,测得固体质量为ng
④称取mg样品溶于适量蒸馏水
⑤洗涤沉淀2-3次.
该同学正确的操作步骤为

(2)乙同学把一定量的混合物与足量盐酸反应,然后用如图装置测定产生的CO2气体的体积,实验室中只有如下试剂:样品、6mol/L盐酸、Na2CO3溶液、CaCl2溶液、饱和NaHCO3溶液.
①广口瓶中盛放的溶液是
②该装置测定的气体体积往往不准确(不考虑导管中水的体积),理由是
(3)丙同学准确称取w g样品放入锥形瓶中,加入V1 mL 0.1000mol/L盐酸,充分反应,用0.1000mol/L的氢氧化钠溶液滴定过量盐酸,消耗氢氧化钠溶液V2 mL.
①实验室现有1.000mol/L盐酸溶液.为了精确配制100mL 0.1000mol/L的盐酸溶液,需要的仪器有:烧杯、100mL容量瓶、玻璃棒、胶头滴管、
②滴定时选择
③混合物中碳酸钠的质量分数为
分析:(1)测定Na2CO3和NaCl混合物中Na2CO3质量分数,设计实验步骤为称量样品溶解后,加入过量氯化钙溶液生成碳酸钙沉淀,过滤洗涤烘干后称量沉淀质量,依据碳酸根离子守恒计算碳酸钠的质量分数;
(2)①把一定量的混合物与足量盐酸反应,然后用如图装置测定产生的CO2气体的体积,是利用排液法测定生成二氧化碳的气体体积进行计算,广口瓶中液体是饱和碳酸氢钠;
②排液法测定气体体积实验过程中,生成的二氧化碳中含有盐酸挥发出的氯化氢气体,排饱和碳酸氢钠溶液会和碳酸氢钠反应生成二氧化碳导致测定结果产生误差;
(3)①依据配制溶液是精确配制,取用溶液体积需要用滴定管分析需要的仪器;
②滴定实验是利用氢氧化钠溶液滴定过量的盐酸来计算与碳酸钠反应的盐酸,反应终点指示剂应选择酚酞试液;
③依据题干实验数据,结合反应过程分析计算碳酸钠质量分数.
(2)①把一定量的混合物与足量盐酸反应,然后用如图装置测定产生的CO2气体的体积,是利用排液法测定生成二氧化碳的气体体积进行计算,广口瓶中液体是饱和碳酸氢钠;
②排液法测定气体体积实验过程中,生成的二氧化碳中含有盐酸挥发出的氯化氢气体,排饱和碳酸氢钠溶液会和碳酸氢钠反应生成二氧化碳导致测定结果产生误差;
(3)①依据配制溶液是精确配制,取用溶液体积需要用滴定管分析需要的仪器;
②滴定实验是利用氢氧化钠溶液滴定过量的盐酸来计算与碳酸钠反应的盐酸,反应终点指示剂应选择酚酞试液;
③依据题干实验数据,结合反应过程分析计算碳酸钠质量分数.
解答:解:(1)测定Na2CO3和NaCl混合物中Na2CO3质量分数,设计实验步骤为称量样品溶解后,加入过量氯化钙溶液生成碳酸钙沉淀,过滤洗涤烘干后称量沉淀质量,正确的操作步骤为:④②①⑤③,称取样品质量为mg,反应生成碳酸钙质量为ng,依据碳酸根离子守恒计算得到,碳酸钠质量分数=
×100%=
%,
故答案为:④②①⑤③;
%;
(2)①利用测定反应生成的二氧化碳气体体积的方法测定,在碳酸氢钠溶液中二氧化碳不反应,溶解度减小,利用装置图排饱和碳酸氢钠溶液测定二氧化碳气体的体积,
故答案为:饱和NaHCO3溶液;
②盐酸和样品反应过程中生成的二氧化碳气体中含有氯化氢气体,通过饱和碳酸氢钠溶液会发生反应H++HCO3-=CO2↑+H2O,导致测定结果偏大,
故答案为:用盐酸与Na2CO3反应产生的CO2中混有HCl,HCl与NaHCO3反应生成了CO2;
(3)①现有1.000mol/L盐酸溶液.为了精确配制100mL 0.1000mol/L的盐酸溶液,需要的仪器有:烧杯、100mL容量瓶、玻璃棒、胶头滴管,准确取用盐酸溶液用酸式滴定管,
故答案为:酸式滴定管;
②利用氢氧化钠溶液滴定过量盐酸,强酸强碱反应终点可以选择酚酞做指示剂,
故答案为:酚酞;
③准确称取w g样品放入锥形瓶中,加入V1 mL 0.1000mol/L盐酸,充分反应,用0.1000mol/L的氢氧化钠溶液滴定过量盐酸,消耗氢氧化钠溶液V2 mL,碳酸钠反应消耗的氯化氢物质的量=V1×10-3L×0.1000mol/L-0.1000mol/L×V2×10-3L,依据化学反应2H++CO32-=CO2↑+H2O,n(CO32-)=
×(V1×10-3L×0.1000mol/L-0.1000mol/L×V×10-3L),则碳酸钠质量分数=
×100%=
×100%,
故答案为:
×100%.
| ||
| mg |
| 106n |
| m |
故答案为:④②①⑤③;
| 106n |
| m |
(2)①利用测定反应生成的二氧化碳气体体积的方法测定,在碳酸氢钠溶液中二氧化碳不反应,溶解度减小,利用装置图排饱和碳酸氢钠溶液测定二氧化碳气体的体积,
故答案为:饱和NaHCO3溶液;
②盐酸和样品反应过程中生成的二氧化碳气体中含有氯化氢气体,通过饱和碳酸氢钠溶液会发生反应H++HCO3-=CO2↑+H2O,导致测定结果偏大,
故答案为:用盐酸与Na2CO3反应产生的CO2中混有HCl,HCl与NaHCO3反应生成了CO2;
(3)①现有1.000mol/L盐酸溶液.为了精确配制100mL 0.1000mol/L的盐酸溶液,需要的仪器有:烧杯、100mL容量瓶、玻璃棒、胶头滴管,准确取用盐酸溶液用酸式滴定管,
故答案为:酸式滴定管;
②利用氢氧化钠溶液滴定过量盐酸,强酸强碱反应终点可以选择酚酞做指示剂,
故答案为:酚酞;
③准确称取w g样品放入锥形瓶中,加入V1 mL 0.1000mol/L盐酸,充分反应,用0.1000mol/L的氢氧化钠溶液滴定过量盐酸,消耗氢氧化钠溶液V2 mL,碳酸钠反应消耗的氯化氢物质的量=V1×10-3L×0.1000mol/L-0.1000mol/L×V2×10-3L,依据化学反应2H++CO32-=CO2↑+H2O,n(CO32-)=
| 1 |
| 2 |
| ||
| wg |
| 5.3×10-3(V1-V2) |
| w |
故答案为:
| 5.3×10-3(V1-V2) |
| w |
点评:本题考查了混合物组成的实验探究测定方法,实验设计过程中的步骤和计算,配制溶液和滴定实验的分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目