网址:http://m.1010jiajiao.com/timu_id_4459315[举报]
研究物质性质的基本方法
1.研究物质性质的基本方法
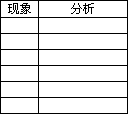
常有________、________、________、________等.
观察要有明确的________,要对观察到的现象进行________.
2.观察钠的物理性质及钠跟水反应的现象
(1)观察提示
观察盛放在试剂瓶中的金属钠的状态及在煤油中的位置;
切开一块钠,观察钠的切面;亲身感觉钠被切割的难易;
观察钠在水中的位置;
观察钠在水中的状态;
观察钠在水中的运动;
耳听钠与水的反应;
将集满气体的试管移近酒精灯的火焰,耳听声音;
观察溶液颜色的变化.
(2)观察记录
①金属钠的物理性质
②金属钠跟水的反应
Na与H2O反应的化学方程式为:2Na+2H2O==2NaOH+H2↑.
3.探索Na跟O2的反应

4Na+O2![]() 2Na2O(白色) 2Na+O2
2Na2O(白色) 2Na+O2![]() Na2O2
Na2O2
认识物质物理性质的方法:(1)直接观察;(2)溶解性实验.
(3)借助仪器分析.
在研究金属钠的性质中用到了观察、实验、分类和比较4种方法.
金属的通性:绝大多数金属是银白色固体,有金属光泽,具有延展性,导电、导热性能;绝大多数金属能跟活泼非金属反应,大部分金属能置换出酸中的氢等等.
完成下列问题:
(1)预测钾的化学性质,完成下列反应的化学方程式.
①钾在氯气中燃烧
| ||
| ||
②点燃钾剧烈燃烧
| ||
| ||
③将小块钾投入冷水中
(2)推测钾在自然界中的存在方式是
(3)该小组研究钾的性质时用到了哪些主要方法:
他们是按照怎样的程序来研究金属钾的性质的:
2CH3COOC2H5
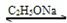 CH3COCH2COOC2H5+C2H5OH
CH3COCH2COOC2H5+C2H5OH反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙酸钠.乙酰乙酸乙酯制备的流程如下:
金属钠,有机液体
| 回流 |
| 振荡② |
| 回收有机液体③ |
| 加入乙酸乙酯④ |
| 乙酸酸化⑤ |
| ⑥ |
| ⑦ |
阅读下面关于乙酰乙酸乙酯制备的实验过程,并回答有关问题.
(1)将适量干净的金属钠放入烧瓶中,为了得到小米状的钠珠,需将钠熔化,为了防止钠的氧化,熔化时需在钠上覆盖一层有机液体,下表是钠和一些常用有机液体的物理性质:
| 钠 | 苯 | 甲苯 | 对二甲苯 | 四氯化碳 | |
| 密度(g/cm3) | 0.97 | 0.88 | 0.87 | 0.86 | 1.60 |
| 熔点(℃) | 97.8 | 5.5 | -95 | 13.3 | -22.8 |
| 沸点(℃) | 881.4 | 80 | 111 | 138.4 | 76.8 |
理由是
(2)将烧瓶中的有机液体小心倾出,迅速加入适量乙酸乙酯,装上带有一根长玻璃导管的单孔胶塞,并在导管上端接一个干燥管.缓缓加热,保持瓶中混合液微沸状态.在实验中,使用烧瓶必须干燥,原料乙酸乙酯必须无水,原因是
烧瓶配上长导管的作用是
(3)步骤⑥为向混合溶液中加入饱和食盐水,其目的是
粗产品(含乙酸乙酯和少量水及乙酸等)经过几步操作,最后成为纯品.
粗产品
| 无水硫酸钠 |
| 过滤 |
| 水浴蒸馏 |
| 减压蒸馏 |
(4)向分离出的乙酰乙酸乙酯粗产品中加无水硫酸钠固体的作用是
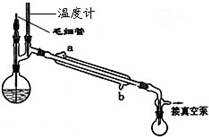
(5)精馏乙酰乙酸乙酯时需要减压蒸馏,装置如图所示.
冷凝管的进出水方向应
(6)实验最后所得产品远少于完全转化的理论产值,除了反应过程中的损耗外,主要原因是
乙酰乙酸乙酯(CH3COCH2COOC2H5)是一种不溶于水的液体,熔点:-45 °C,沸点:180.8℃,它是有机合成中常用的原料。在实验室,它可以由乙酸乙酯在乙醇钠的催化作用下缩合而制得,反应式为:2CH3COOC2H5  CH3COCH2COOC2H5+C2H5OH。反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙醇钠。乙酰乙酸乙酯制备的流程如下:
CH3COCH2COOC2H5+C2H5OH。反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙醇钠。乙酰乙酸乙酯制备的流程如下:

阅读下面关于乙酰乙酸乙酯制备的实验过程,并回答有关问题。
(1)将适量干净的金属钠放入烧瓶中,为了得到小米状的钠珠,需将钠熔化,为了防止钠的氧化,熔化时需在钠上覆盖一层有机液体,下表是钠和一些常用有机液体的物理性质:
| 钠 | 苯 | 甲苯 | 对二甲苯 | 四氯化碳 |
密度(g/cm3) | 0.97 | 0.88 | 0.87 | 0.86 | 1.60 |
熔点(℃) | 97.8 | 5.5 | -95 | 13.3 | -22.8 |
沸点(℃) | 881.4 | 80 | 111 | 138. 4 | 76.8 |
最好选用??????? 来熔化钠。是否能用四氯化碳??? (填“是”或“否”)理由是??????????? 。
(2)将烧瓶中的有机液体小心倾出,迅速加入适量乙酸乙酯,装上带有一根长玻璃导管的单孔胶塞,并在导管上端接一个干燥管。缓缓加热,保持瓶中混合液微沸状态。在实验中,使用烧瓶必须干燥,原料乙酸乙酯必须无水,原因是?????????????? 。烧瓶配上长导管的作用是????????????????? ,导管上端接一干燥管的目的是??????????????????????? 。
(3)步骤⑥为向混合溶液中加入饱和食盐水,其目的是??????????????? ,写出步骤⑦实验操作的主要仪器???????? (填最主要一种)。
粗产品(含乙酸乙酯和少量水及乙酸等)经过几步操作,最后成为纯品。

(4)向分离出的乙酰乙酸乙酯粗产品中加无水硫酸钠固体的作用是??????????? 。
(5)精馏乙酰乙酸乙酯时需要减压蒸馏,装置如图所示。冷凝管的进出水方向应????? 口进,????? 口出。毛细管的作用是???????? 。

查看习题详情和答案>>
2CH3COOC2H5

CH3COCH2COOC2H5+C2H5OH
反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙酸钠.乙酰乙酸乙酯制备的流程如下:
金属钠,有机液体
| 回流 |
| 振荡② |
| 回收有机液体③ |
| 加入乙酸乙酯④ |
| 乙酸酸化⑤ |
| ⑥ |
| ⑦ |
阅读下面关于乙酰乙酸乙酯制备的实验过程,并回答有关问题.
(1)将适量干净的金属钠放入烧瓶中,为了得到小米状的钠珠,需将钠熔化,为了防止钠的氧化,熔化时需在钠上覆盖一层有机液体,下表是钠和一些常用有机液体的物理性质:
| 钠 | 苯 | 甲苯 | 对二甲苯 | 四氯化碳 | |
| 密度(g/cm3) | 0.97 | 0.88 | 0.87 | 0.86 | 1.60 |
| 熔点(℃) | 97.8 | 5.5 | -95 | 13.3 | -22.8 |
| 沸点(℃) | 881.4 | 80 | 111 | 138.4 | 76.8 |
理由是______.
(2)将烧瓶中的有机液体小心倾出,迅速加入适量乙酸乙酯,装上带有一根长玻璃导管的单孔胶塞,并在导管上端接一个干燥管.缓缓加热,保持瓶中混合液微沸状态.在实验中,使用烧瓶必须干燥,原料乙酸乙酯必须无水,原因是______,
烧瓶配上长导管的作用是______,导管上端接一干燥管的目的是______.
(3)步骤⑥为向混合溶液中加入饱和食盐水,其目的是______,写出步骤⑦实验操作的主要仪器______(填最主要一种).
粗产品(含乙酸乙酯和少量水及乙酸等)经过几步操作,最后成为纯品.

粗产品
| 无水硫酸钠 |
| 过滤 |
| 水浴蒸馏 |
| 减压蒸馏 |
(4)向分离出的乙酰乙酸乙酯粗产品中加无水硫酸钠固体的作用是______.
(5)精馏乙酰乙酸乙酯时需要减压蒸馏,装置如图所示.
冷凝管的进出水方向应______口进,______口出.毛细管的作用是______.
(6)实验最后所得产品远少于完全转化的理论产值,除了反应过程中的损耗外,主要原因是______.