摘要:(1)CaC2+2H2O→HC≡CH↑+Ca(OH)2 (2)C A E B G F D (3)CaS+2H2OH2S↑+Ca(OH)2 H2S+CuSO4CuS↓(黑)+H2SO4
网址:http://m.1010jiajiao.com/timu_id_4454415[举报]
(2011?宝鸡模拟)A、B、C、D、E分别属于周期表中前20号元素,其原子序数依次递增,并且其中只有一种金属元素.A是元素周期表所有元素中原子半径最小的;B和C 都只有两个电子层,B中一层电子数是另一层的两倍;C 中两层电子数之和是两层电子数之差的两倍; D中一层电子数是另两层电子数之和;E 核外各层电子数两两相等.
请按要求回答下列问题:
(1)画出E 的离子结构示意图
 ,写出由A 和C 组成的含有非极性键的化合物的电子式
,写出由A 和C 组成的含有非极性键的化合物的电子式
 .
.
(2)由上述元素组成的化合物中属于极性键构成的非极性分子是
(3)由C 与E 形成的化合物高温时与B反应生成两种化合物,请写出该反应的化学方程式
(4)写出上述元素形成的化合物中一种可溶性的正盐与另一种强酸反应的离子方程式:
(5)上述元素形成的化合物中通常能污染空气的是
查看习题详情和答案>>
请按要求回答下列问题:
(1)画出E 的离子结构示意图




(2)由上述元素组成的化合物中属于极性键构成的非极性分子是
CH4、CO2、CS2
CH4、CO2、CS2
. (只要求写出两种,用化学式表示)(3)由C 与E 形成的化合物高温时与B反应生成两种化合物,请写出该反应的化学方程式
CaO+3C
CaC2+CO↑
| ||
CaO+3C
CaC2+CO↑
| ||
(4)写出上述元素形成的化合物中一种可溶性的正盐与另一种强酸反应的离子方程式:
Ca2++2CH3COO-+2H++SO42-=2CH3COOH+CaSO4↓
Ca2++2CH3COO-+2H++SO42-=2CH3COOH+CaSO4↓
(5)上述元素形成的化合物中通常能污染空气的是
CO、SO2、H2S等
CO、SO2、H2S等
(至少写出两种).某一种可污染空气的化合物与强氧化剂单质常温下反应生成两种化合物,该反应的化学方程式为:H2S+O3=SO2+H2O
H2S+O3=SO2+H2O
.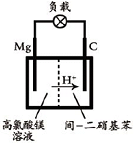 (2012?江苏一模)镁及其合金广泛应用于航空航天、交通、电池等行业,金属镁的制备方法主要有:
(2012?江苏一模)镁及其合金广泛应用于航空航天、交通、电池等行业,金属镁的制备方法主要有:①电解无水氯化镁法,②碳或碳化钙热还原法,③皮江法.
已知:
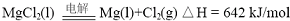
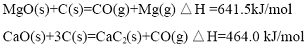
(1)写出MgO(s)与CaC2(s)作用生成Mg(g)及CaO(s)及C(s)的热化学方程式:
CaC2(s)+MgO(s)=CaO(s)+Mg(g)+2C(s),△H=(641.5-464.0)kJ/mol=177.5kJ/mol
CaC2(s)+MgO(s)=CaO(s)+Mg(g)+2C(s),△H=(641.5-464.0)kJ/mol=177.5kJ/mol
.(2)碳化钙还原氧化镁的文献资料如表2
表2 还原剂的用量与温度、保温时间计MgO还原率
| n(CaC2)/N(MgO) | 还原温度/℃ | 恒温时间/h | 还原率/% |
| 1.1 | 1110 | 2.0 | 62 |
| 1.1 | 1150 | 2.0 | 80 |
| 1.1 | 1150 | 2.5 | 85 |
| 1.2 | 1000 | 2.0 | 33 |
| 1.2 | 1150 | 2.0 | 84 |
| 1.2 | 1150 | 2.5 | 88 |
| 1.3 | 1150 | 2.0 | 86 |
| 1.3 | 1150 | 2.0 | 88 |
相同条件下延长保温时间时,还原率增加不明显,生成成本增大
相同条件下延长保温时间时,还原率增加不明显,生成成本增大
;采用n(CaC2)/n(MgO)配比为1.2,而不是1.3,其主要原因是:相同条件下,还原剂配比由1.2升高到1.3,还原剂用量增大,还原率增加不明显,生产成本增大
相同条件下,还原剂配比由1.2升高到1.3,还原剂用量增大,还原率增加不明显,生产成本增大
.(3)用电解法制取镁时,若原料氯化镁含有水时,在电解温度下,原料会形成Mg(OH)Cl,并发生电离反应:Mg(OH)Cl=Mg(OH)++Cl-.电解时在阴极表面会产生氧化镁钝化膜,此时阴极的反应式为
2Mg(OH)++2e-=MgO+H2↑
2Mg(OH)++2e-=MgO+H2↑
.实验室由MgCl2?6H2O制取无水氯化镁可采用的方法是在氯化氢气流中加热脱水
在氯化氢气流中加热脱水
.(4)我国目前生产金属镁主要用皮江法生产,其原料为白云石(MgCO3?CaCO3)的煅烧产物和硅铁(含75%Si).其生产原理为:
2CaO+2MgO(s)+Si(s)
| 1100-1250℃ |
| 真空 |
防止硅和镁被氧化,并提高金属镁的产率
防止硅和镁被氧化,并提高金属镁的产率
.(5)镁/间-二硝基苯电池的装置如图所示,电池工作时镁转变为氢氧化镁,间-二硝基苯则转变为间-二苯胺.该电池正极的电极反应式为

