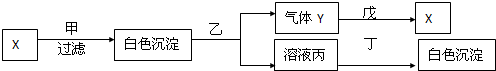
题目内容
(2011?宝鸡模拟)A、B、C、D、E分别属于周期表中前20号元素,其原子序数依次递增,并且其中只有一种金属元素.A是元素周期表所有元素中原子半径最小的;B和C 都只有两个电子层,B中一层电子数是另一层的两倍;C 中两层电子数之和是两层电子数之差的两倍; D中一层电子数是另两层电子数之和;E 核外各层电子数两两相等.
请按要求回答下列问题:
(1)画出E 的离子结构示意图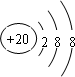
 ,写出由A 和C 组成的含有非极性键的化合物的电子式
,写出由A 和C 组成的含有非极性键的化合物的电子式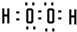
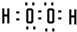 .
.
(2)由上述元素组成的化合物中属于极性键构成的非极性分子是
(3)由C 与E 形成的化合物高温时与B反应生成两种化合物,请写出该反应的化学方程式
(4)写出上述元素形成的化合物中一种可溶性的正盐与另一种强酸反应的离子方程式:
(5)上述元素形成的化合物中通常能污染空气的是
请按要求回答下列问题:
(1)画出E 的离子结构示意图


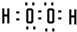
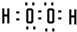
(2)由上述元素组成的化合物中属于极性键构成的非极性分子是
CH4、CO2、CS2
CH4、CO2、CS2
. (只要求写出两种,用化学式表示)(3)由C 与E 形成的化合物高温时与B反应生成两种化合物,请写出该反应的化学方程式
CaO+3C
CaC2+CO↑
| ||
CaO+3C
CaC2+CO↑
| ||
(4)写出上述元素形成的化合物中一种可溶性的正盐与另一种强酸反应的离子方程式:
Ca2++2CH3COO-+2H++SO42-=2CH3COOH+CaSO4↓
Ca2++2CH3COO-+2H++SO42-=2CH3COOH+CaSO4↓
(5)上述元素形成的化合物中通常能污染空气的是
CO、SO2、H2S等
CO、SO2、H2S等
(至少写出两种).某一种可污染空气的化合物与强氧化剂单质常温下反应生成两种化合物,该反应的化学方程式为:H2S+O3=SO2+H2O
H2S+O3=SO2+H2O
.分析:A是元素周期表所有元素中原子半径最小的,则A为H元素;E核外各层电子数两两相等,则E为Ca元素.
A、B、C、D、E分别属于周期表中前20号元素,其原子序数依次递增,并且其中只有一种金属元素.B中一层电子数是另一层的两倍,则B为C元素;C 中两层电子数之和是两层电子数之差的两倍,则C为O元素;D中一层电子数是另两层电子数之和,则D为S元素.
A、B、C、D、E分别属于周期表中前20号元素,其原子序数依次递增,并且其中只有一种金属元素.B中一层电子数是另一层的两倍,则B为C元素;C 中两层电子数之和是两层电子数之差的两倍,则C为O元素;D中一层电子数是另两层电子数之和,则D为S元素.
解答:解:A是元素周期表所有元素中原子半径最小的,则A为H元素;E核外各层电子数两两相等,则E为Ca元素.
A、B、C、D、E分别属于周期表中前20号元素,其原子序数依次递增,并且其中只有一种金属元素.B中一层电子数是另一层的两倍,则B为C元素;C 中两层电子数之和是两层电子数之差的两倍,则C为O元素;D中一层电子数是另两层电子数之和,则D为S元素.
即A为H元素;B为C元素;C为O元素;D为S元素;E为Ca元素.
(1)E为Ca元素,Ca2+核内质子数为20,核外18个电子,有3个电子层,最外层有8个电子,离子结构示意图为 .
.
A和C组成的含有非极性键的化合物是H2O2,过氧化氢电子式为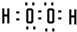 .
.
故答案为: ;
;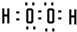 .
.
(2)上述元素组成的化合物中属于极性键构成的非极性分子有CH4、CO2、CS2.
故答案为:CH4、CO2、CS2.
(3)由C与E形成的化合物为CaO,高温时与碳反应生成CaC2和CO,反应方程式为CaO+3C
CaC2+CO↑.
故答案为:CaO+3C
CaC2+CO↑.
(4)上述元素组成的可溶性盐为醋酸钙,强酸为硫酸,反应离子方程式为Ca2++2CH3COO-+2H++SO42-=2CH3COOH+CaSO4↓.
故答案为:Ca2++2CH3COO-+2H++SO42-=2CH3COOH+CaSO4↓.
(5)上述元素形成的化合物中通常能污染空气的是CO、SO2、H2S 等;
臭氧具有强氧化性,硫化氢具有较强的还原性,二者发生反应 H2S+O3=SO2+H2O.
故答案为:CO、SO2、H2S 等;H2S+O3=SO2+H2O.
A、B、C、D、E分别属于周期表中前20号元素,其原子序数依次递增,并且其中只有一种金属元素.B中一层电子数是另一层的两倍,则B为C元素;C 中两层电子数之和是两层电子数之差的两倍,则C为O元素;D中一层电子数是另两层电子数之和,则D为S元素.
即A为H元素;B为C元素;C为O元素;D为S元素;E为Ca元素.
(1)E为Ca元素,Ca2+核内质子数为20,核外18个电子,有3个电子层,最外层有8个电子,离子结构示意图为
 .
.A和C组成的含有非极性键的化合物是H2O2,过氧化氢电子式为
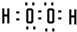 .
.故答案为:
 ;
;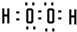 .
.(2)上述元素组成的化合物中属于极性键构成的非极性分子有CH4、CO2、CS2.
故答案为:CH4、CO2、CS2.
(3)由C与E形成的化合物为CaO,高温时与碳反应生成CaC2和CO,反应方程式为CaO+3C
| ||
故答案为:CaO+3C
| ||
(4)上述元素组成的可溶性盐为醋酸钙,强酸为硫酸,反应离子方程式为Ca2++2CH3COO-+2H++SO42-=2CH3COOH+CaSO4↓.
故答案为:Ca2++2CH3COO-+2H++SO42-=2CH3COOH+CaSO4↓.
(5)上述元素形成的化合物中通常能污染空气的是CO、SO2、H2S 等;
臭氧具有强氧化性,硫化氢具有较强的还原性,二者发生反应 H2S+O3=SO2+H2O.
故答案为:CO、SO2、H2S 等;H2S+O3=SO2+H2O.
点评:本题考查原子结构与元素周期律的关系,题目难度不大,正确推断元素的种类是解答本题的关键,要正确把握元素周期律的递变规律.

练习册系列答案
相关题目
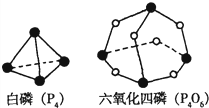 (2011?宝鸡模拟)化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷(P4)和P4O6的分子结构如图所示;
(2011?宝鸡模拟)化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知白磷(P4)和P4O6的分子结构如图所示;