摘要:3.运用所学知识和技能进行实验设计或处理 近年来.实验题中新情境试题不断增多.这类试题的特点是将基本的实验操作设计置于新的情境中(主要是中学课本没有的新反应或新装置或是能使中学生理解的最新科技知识.简化的改进的装置等).结合学生原有的知识和能力.来进行仪器组装.现象描述.数据分析.考虑安全和防污等.用来考查考生自学能力.思维能力.分析综合及评价的能力.由于这类实验试题情境新颖.设问巧妙.铺垫得当.知识新.思维量大.所以区分度很好.能确实将一些基础扎实.自学能力强.思维敏捷.心理素质好的考生选拨出来.所以.新情境实验试题将是今后实验试题的命题方向. 由以上分析不难看出.尽管化学实验部分涉及到的知识和能力点是分散的.但高考试题中实验考查的内容和形式是较为稳定的.这给实验复习中突出重点提供了可能.实验复习根据考纲和高考试题的几个特点方面.设计化学实验专题加以重点复习.就会起到事半功倍的效果. 复习教学方法设计 化学实验的复习是整个化学总复习中一个非常重要的环节.它不但可以巩固和强化有关化学实验知识和能力.也能对元素化学物知识.化学基本理论和化学计算内容的掌握起到促进和深化作用.由于化学实验部分的内容多且在课本中十分的分散.在实验复习教学中.必须有的放矢.突出重点.这个“的 就是“考试说明 所规定的考查内容.而重点就是历年来高考试题中所反映的考试内容.在进行实验部分的专题复习中应该注意以下几点:
网址:http://m.1010jiajiao.com/timu_id_4452318[举报]
(一)铝是生活中非常常见的一种金属,运用所学知识回答:
(1)金属铝是活泼的金属,但在生活中应用很广泛,原因是
(2)铝盐或铁盐能用于净水,是因为铝盐或铁盐在水溶液中形成了
(3)铝粉与氧化铁粉末在高温下得到铁的反应叫做“铝热反应”,发生反应的化学方程式为
(二)有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,设计实验证明矿物样品中有Fe3+.实验用品:研钵、烧杯、玻璃棒、漏斗、铁架台、滤纸、试管、胶头滴管
(4)简述实验操作步骤、现象和结论
查看习题详情和答案>>
(1)金属铝是活泼的金属,但在生活中应用很广泛,原因是
铝表面容易生成一层致密的氧化物保护膜,对内部的金属起到了保护作用
铝表面容易生成一层致密的氧化物保护膜,对内部的金属起到了保护作用
.(2)铝盐或铁盐能用于净水,是因为铝盐或铁盐在水溶液中形成了
胶体
胶体
.(3)铝粉与氧化铁粉末在高温下得到铁的反应叫做“铝热反应”,发生反应的化学方程式为
2Al+Fe2O3
2Fe+Al2O3
| ||
2Al+Fe2O3
2Fe+Al2O3
.
| ||
(二)有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,设计实验证明矿物样品中有Fe3+.实验用品:研钵、烧杯、玻璃棒、漏斗、铁架台、滤纸、试管、胶头滴管
(4)简述实验操作步骤、现象和结论
将样品在研钵中研细,倒入烧杯,加入稀硫酸,搅拌,过滤,取少许溶液,滴加KSCN溶液,若溶液变为红色,则证明矿物样品中有Fe3+,不变红,则无
将样品在研钵中研细,倒入烧杯,加入稀硫酸,搅拌,过滤,取少许溶液,滴加KSCN溶液,若溶液变为红色,则证明矿物样品中有Fe3+,不变红,则无
.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.如图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
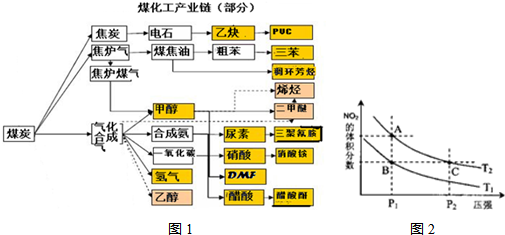
(1)该产业链中属于高中阶段常见的在低温下能自发进行的反应是:
(2)已知该产业链中某反应的平衡表达式为:
K=
它所对应的化学反应为:
(3)已知在一定温度下,
C(s)+CO2(g)?2CO(g)平衡常数K1;
CO(g)+H2O(g )?H2(g)+CO2(g)平衡常数K2;
C(s)+H2O(g)?CO(g)+H2(g) 平衡常数K3;
则K1、K2、K3之间的关系是:
(4)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
该反应的正反应方向是
(5)从图1看出氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是 和
和 .实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式
.实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(6)0.2mol/L的NaOH与0.4mol/L的上述产业链中一产品化肥硝酸铵溶液等体积混合后,溶液中所有分子和离子( 除水和氨分子外)等微粒从大到小的顺序是
(7)以上述产业链中甲醇为燃料制成燃料电池,请写出在氢氧化钾介质中该电池的负极反应式
查看习题详情和答案>>

(1)该产业链中属于高中阶段常见的在低温下能自发进行的反应是:
N2+3H2?2NH3或NH3+HNO3═NH4NO3
N2+3H2?2NH3或NH3+HNO3═NH4NO3
(2)已知该产业链中某反应的平衡表达式为:
K=
| c(H2)c(CO) |
| c(H2O) |
C(s)+H2O(g)?CO(g)+H2(g)
C(s)+H2O(g)?CO(g)+H2(g)
(3)已知在一定温度下,
C(s)+CO2(g)?2CO(g)平衡常数K1;
CO(g)+H2O(g )?H2(g)+CO2(g)平衡常数K2;
C(s)+H2O(g)?CO(g)+H2(g) 平衡常数K3;
则K1、K2、K3之间的关系是:
K3=K1×K2
K3=K1×K2
.(4)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
放热
放热
反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为:75%
75%
.(5)从图1看出氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是
 和
和 .实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式
.实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的键能为466kJ?mol-1,N2O4中氮氧键的键能为438.5kJ?mol-1.请写出NO2转化为N2O4的热化学方程式2NO2(g)?N2O4(g)△H=-57kJ?mol-1
2NO2(g)?N2O4(g)△H=-57kJ?mol-1
.对反应N2O4(g)?2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示.下列说法正确的是D
D
.A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(6)0.2mol/L的NaOH与0.4mol/L的上述产业链中一产品化肥硝酸铵溶液等体积混合后,溶液中所有分子和离子( 除水和氨分子外)等微粒从大到小的顺序是
c(NO3-)>c(NH4+)>c(Na+)>c(NH3?H2O)>c(OH-)>c(H+)
c(NO3-)>c(NH4+)>c(Na+)>c(NH3?H2O)>c(OH-)>c(H+)
.(7)以上述产业链中甲醇为燃料制成燃料电池,请写出在氢氧化钾介质中该电池的负极反应式
CH3OH+8OH--6e-═CO32-+6H2O
CH3OH+8OH--6e-═CO32-+6H2O
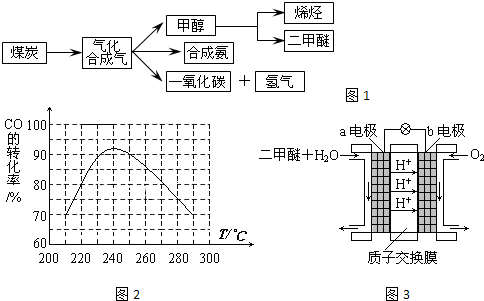
.图1是煤化工产业链的一部分,试运用所学知识,解决下列问题:
I.已知该产业链中某反应的平衡表达式为:K=
,它所对应反应的化学方程式为
II.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)
CH3OH(g)△H1=-90.7kJ?mol-1
②2CH3OH(g)
CH3OCH3(g)+H2O(g)△H2=-23.5kJ?mol-1
③CO(g)+H2O(g)
CO2(g)+H2(g)△H3=-41.2kJ?mol-1
(1)催化反应室中总反应的热化学方程式为
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1mol/L,c(H2)=2.4mol/L,5min后达到平衡,CO的转化率为50%,则5min内CO的平均反应速率为
(3)为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果如图2,CO转化率随温度变化的规律是
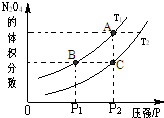
(4)“二甲醚燃料电池”是一种绿色电源,其工作原理如图3所示.写出a电极上发生的电极反应式
查看习题详情和答案>>
I.已知该产业链中某反应的平衡表达式为:K=
| C(H2)?C(CO) |
| C(H2O) |
C(s)+H2O(g)?CO(g)+H2(g)
C(s)+H2O(g)?CO(g)+H2(g)
.II.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)
| 高温 |
②2CH3OH(g)
| 高温 |
③CO(g)+H2O(g)
| 高温 |
(1)催化反应室中总反应的热化学方程式为
3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-247KJ?mol-1
3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-247KJ?mol-1
.830℃时反应③的K=1.0,则在催化反应室中反应③的K>
>
1.0(填“>”、“<”或“=”).(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1mol/L,c(H2)=2.4mol/L,5min后达到平衡,CO的转化率为50%,则5min内CO的平均反应速率为
0.1mol/(L?min)
0.1mol/(L?min)
;若反应物的起始浓度分别为:c(CO)=4mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2mol/L,a=5.4
5.4
mol/L.(3)为了寻找合适的反应温度,研究者进行了一系列试验,每次试验保持原料气组成、压强、反应时间等因素不变,试验结果如图2,CO转化率随温度变化的规律是
由图表可知,温度低于240℃时,CO的转化率随着温度的升高而增大;温度高于240℃时,CO的转化率随着温度的升高而减小
由图表可知,温度低于240℃时,CO的转化率随着温度的升高而增大;温度高于240℃时,CO的转化率随着温度的升高而减小
,其原因是在较低温时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,各反应体系均已达到平衡,CO的转化率主要受反应限度影响,随着温度的升高平衡向逆反应方向移动,CO的转化率减小
在较低温时,各反应体系均未达到平衡,CO的转化率主要受反应速率影响,随着温度的升高反应速率增大,CO的转化率也增大;在较高温时,各反应体系均已达到平衡,CO的转化率主要受反应限度影响,随着温度的升高平衡向逆反应方向移动,CO的转化率减小
.(4)“二甲醚燃料电池”是一种绿色电源,其工作原理如图3所示.写出a电极上发生的电极反应式
CH3OCH3+3H2O-12e-=2CO2+12H+
CH3OCH3+3H2O-12e-=2CO2+12H+
.
 研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:
研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:(1)生产水煤气过程中有以下反应:
①C(s)+CO2(g)?2CO(g)△H1;
②CO(g)+H2O(g)?H2(g)+CO2(g)△H2;
③C(s)+H2O(g)?CO(g)+H2(g)△H3;
若平衡表达式为K=
| c(H2)?c(CO) |
| c(H2O) |
△H2、△H3之间的关系为
(2)不同温度下反应②的平衡常数如下表所示.则△H2
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
氧化还原反应和离子反应是高一所学过的重要化学反应类型,仔细思考回答下列问题:
(Ⅰ)下列一组有水参与的反应:
①2Na+2H2O=2NaOH+H2↑
②2Na2O2+2H2O=4NaOH+O2↑
③Na2O+H2O=2NaOH
④3Fe+4H2O
Fe3O4+4H2
⑤2H2O
2H2↑+O2↑
⑥2F2+2H2O=4HF+O2
(1)其中不属于氧化还原反应的是
(2)在这些氧化还原反应中,水只作氧化剂的反应是
水只作还原剂的反应是
水既不作氧化剂,又不作还原剂是
(3)根据你的理解,氧化还原反应的实质是
A.分子中的原子重新组合 B.氧元素的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
(4)请你运用所学知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?
(Ⅱ)写出下列反应的离子方程式:
①往氯化铁溶液加入铁粉:
②过量二氧化碳通入澄清石灰水:
③往氯化铝溶液中加入足量的NaOH溶液:
(Ⅲ)写出下列反应的化学方程式:
①二氧化硫发生催化氧化反应:
②氯气与氢氧化钠溶液反应:
③铜片与稀硝酸的反应:
查看习题详情和答案>>
(Ⅰ)下列一组有水参与的反应:
①2Na+2H2O=2NaOH+H2↑
②2Na2O2+2H2O=4NaOH+O2↑
③Na2O+H2O=2NaOH
④3Fe+4H2O
| ||
⑤2H2O
| ||
⑥2F2+2H2O=4HF+O2
(1)其中不属于氧化还原反应的是
③
③
(填编号)(2)在这些氧化还原反应中,水只作氧化剂的反应是
①④
①④
(填编号)水只作还原剂的反应是
⑥
⑥
(填编号)水既作氧化剂,又作还原剂是⑤
⑤
(填编号)水既不作氧化剂,又不作还原剂是
③
③
(填编号)(3)根据你的理解,氧化还原反应的实质是
C
C
A.分子中的原子重新组合 B.氧元素的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
(4)请你运用所学知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?
是
是
(填“是”或“不是”),若是,这个反应的氧化剂是NO2
NO2
,还原剂是NO2
NO2
.(Ⅱ)写出下列反应的离子方程式:
①往氯化铁溶液加入铁粉:
2Fe3++Fe=3Fe2+
2Fe3++Fe=3Fe2+
②过量二氧化碳通入澄清石灰水:
CO2+OH-=HCO3-
CO2+OH-=HCO3-
③往氯化铝溶液中加入足量的NaOH溶液:
Al3++4OH-=AlO2-+2H2O
Al3++4OH-=AlO2-+2H2O
(Ⅲ)写出下列反应的化学方程式:
①二氧化硫发生催化氧化反应:
2SO2+O2
2SO3
| ||
| 高温高压 |
2SO2+O2
2SO3
| ||
| 高温高压 |
②氯气与氢氧化钠溶液反应:
Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+2NaOH=NaCl+NaClO+H2O
③铜片与稀硝酸的反应:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
.