网址:http://m.1010jiajiao.com/timu_id_4450144[举报]
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(1)T的原子结构示意图为


(2)元素的非金属性为(原子的得电子能力):Q
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为
| ||
| ||
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是
| ||
| ||
(5)写出T、W两元素的最高价氧化物对应水化物相互反应时的离子方程式
 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:(1)元素的非金属性为(原子的得电子能力):Q
(2)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是
| ||
| ||
(3)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ.又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的△H=
| Q | R | ||
| T | W |
(2)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质.其中一种是气体,反应的化学方程式为
(3)Q、R元素可以形成一种新型的耐高温陶瓷材料,其化学式为
(4)Q、W元素组成的液态化合物,其结构式为
(15分)
![]()
 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
![]() (1)T的原子结构示意图为_______.
(1)T的原子结构示意图为_______.
![]() (2)元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。
(2)元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。
![]() (3) W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____.
(3) W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____.
![]() (4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________.
(4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________.
![]() (5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氯气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是__________.
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氯气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是__________.
![]() (6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的![]() =________(注:题中所设单质均为最稳定单质)
=________(注:题中所设单质均为最稳定单质)
![]() 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
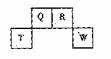
![]() (1)T的原子结构示意图为_______.
(1)T的原子结构示意图为_______.
![]() (2)元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。
(2)元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。
![]() (3) W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____.
(3) W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_____.
![]() (4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________.
(4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________.
![]() (5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氯气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是__________.
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氯气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是__________.
![]() (6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的![]() =________(注:题中所设单质均为最稳定单质)
=________(注:题中所设单质均为最稳定单质)
![]()