题目内容
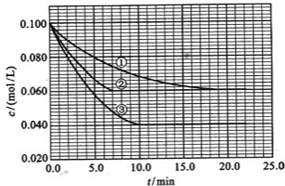
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(1)T的原子结构示意图为 .
(2)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质.其中一种是气体,反应的化学方程式为 .
(3)Q、R元素可以形成一种新型的耐高温陶瓷材料,其化学式为 ,属于 晶体.
(4)Q、W元素组成的液态化合物,其结构式为 .1mol该化合物在空气中燃烧,消耗3mol O2,生成两种气体化合物,放出热量a kJ.写出该反应的热化学方程式: .
| Q | R | ||
| T | W |
(2)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质.其中一种是气体,反应的化学方程式为
(3)Q、R元素可以形成一种新型的耐高温陶瓷材料,其化学式为
(4)Q、W元素组成的液态化合物,其结构式为
分析:由短周期元素Q、R、T、W在元素周期表中的位置可知,Q、R处于第二周期,T、W处于第三周期,由于T所处的周期序数与主族族序数相等,则T是Al,可推知Q是C,R是N,W是S,
(1)Al原子质子数为13,核外电子数为13,各层电子数分别为2、8、3;
(2)S与浓硫酸在加热条件下生成二氧化硫与水;
(3)C、N元素可以形成一种新型的耐高温陶瓷材料,应属于原子晶体,结合化合价可知其化学式为C3N4;
(4)C、S元素组成的液态化合物为CS2,与二氧化碳结构相似,分子中C原子与S原子之间形成2对共用电子对;CS2燃烧生成二氧化碳、二氧化硫,注明物质的聚集状态以及反应热数值、符号、单位,据此书写热化学方程式.
(1)Al原子质子数为13,核外电子数为13,各层电子数分别为2、8、3;
(2)S与浓硫酸在加热条件下生成二氧化硫与水;
(3)C、N元素可以形成一种新型的耐高温陶瓷材料,应属于原子晶体,结合化合价可知其化学式为C3N4;
(4)C、S元素组成的液态化合物为CS2,与二氧化碳结构相似,分子中C原子与S原子之间形成2对共用电子对;CS2燃烧生成二氧化碳、二氧化硫,注明物质的聚集状态以及反应热数值、符号、单位,据此书写热化学方程式.
解答:解:由短周期元素Q、R、T、W在元素周期表中的位置可知,Q、R处于第二周期,T、W处于第三周期,由于T所处的周期序数与主族族序数相等,则T是Al,可推知Q是C,R是N,W是S,
(1)Al原子质子数为13,核外电子数为13,各层电子数分别为2、8、3,其原子结构示意图为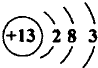 ,故答案为:
,故答案为: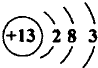 ;
;
(2)S与浓硫酸在加热条件下生成二氧化硫与水,反应方程式为S+2H2O4(浓)
3SO2↑+2H2O,
故答案为:S+2H2O4(浓)
3SO2↑+2H2O;
(3)C、N元素可以形成一种新型的耐高温陶瓷材料,应属于原子晶体,结合化合价可知其化学式为C3N4,
故答案为:C3N4;原子晶体;
(4)C、S元素组成的液态化合物为CS2,与二氧化碳结构相似,分子中C原子与S原子之间形成2对共用电子对,其结构式为S=C=S;1mol该化合物在空气中燃烧,消耗3mol O2,生成两种气体化合物为二氧化碳与二氧化硫,放出热量a kJ,该反应的热化学方程式:CS2(1)+3O2(g)=CO2(g)+2SO2(g)△H=-a kJ/mol,
故答案为:S=C=S;CS2(1)+3O2(g)=CO2(g)+2SO2(g)△H=-a kJ/mol.
(1)Al原子质子数为13,核外电子数为13,各层电子数分别为2、8、3,其原子结构示意图为
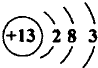 ,故答案为:
,故答案为: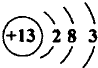 ;
;(2)S与浓硫酸在加热条件下生成二氧化硫与水,反应方程式为S+2H2O4(浓)
| ||
故答案为:S+2H2O4(浓)
| ||
(3)C、N元素可以形成一种新型的耐高温陶瓷材料,应属于原子晶体,结合化合价可知其化学式为C3N4,
故答案为:C3N4;原子晶体;
(4)C、S元素组成的液态化合物为CS2,与二氧化碳结构相似,分子中C原子与S原子之间形成2对共用电子对,其结构式为S=C=S;1mol该化合物在空气中燃烧,消耗3mol O2,生成两种气体化合物为二氧化碳与二氧化硫,放出热量a kJ,该反应的热化学方程式:CS2(1)+3O2(g)=CO2(g)+2SO2(g)△H=-a kJ/mol,
故答案为:S=C=S;CS2(1)+3O2(g)=CO2(g)+2SO2(g)△H=-a kJ/mol.
点评:本题考查结构性质位置关系,涉及元素周期表、原子结构示意图、热化学方程式、晶体类型与性质等,难度不大,推断元素是解题关键,注意同主族元素化合物的相似性与递变性.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
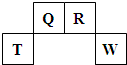 (2009?福建)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.
(2009?福建)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,
 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中元素T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中元素T所处的周期序数与主族序数相等,请回答下列问题:
 (2013?番禺区模拟)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列推断正确的是( )
(2013?番禺区模拟)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列推断正确的是( )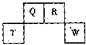 (2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(2012?长宁区一模)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: