摘要:运用化学反应原理研究氮.氧等单质及其化合物的反应有重要意义. (1)合成氨反应反应N2(g)+3H2(g)2NH3(g).若在恒温.恒压条件下向平衡体系中通入氩气.平衡 移动(填“向左 “向右 或“不 ),.使用催化剂 反应的ΔH(填“增大 “减小 或“不改变 ). (2)O2 (g)= O+2(g)+e- H1= 1175.7 kJ·mol-1 PtF6(g)+ e-1 PtF6-(g) H2= - 771.1 kJ·mol-1 O2+PtF6-(s)=O2+(g)+PtF6- H3=482.2 kJ·mol-1 则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的H= kJ·mol-1. (3)在25℃下.向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水.先生成 沉淀.生成该沉淀的离子方程式为 .已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20. (4)在25℃下.将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合.反应平衡时溶液中c(NH4*)=c(Cl-).则溶液显 性,用含a的代数式表示NH3·H2O的电离常数Kb= . [答案] -77.6 2 Cu2++2NH3·H2O=Cu(OH)2 ↓+2NH4+ (4)中 Kb=10-9/mol·L-1. [解析](1)在恒压条件下加入氩气.则容积增大.导致原平衡中各物质的浓度同等比例减小.所以平衡向气体体积增大的方向即向左移动,催化剂仅是改变化学反应速率.不会影响焓变.(2)根据盖斯定律.将化学方程式①+②-③叠加.2 的Ksp小于Mg(OH)2的.所以离子的浓度商首先大于Cu(OH)2 的而先沉淀,由于氨水是弱碱.书写离子方程式时不能拆开.(4)由溶液的电荷守恒可得: c(H*)+c(NH4*)=c(Cl-)+c(OH-),已知c(NH4*)=c(Cl-).则有c(H*)=c(OH-).溶液显中性,电离常数只与温度有关.则此时NH3·H2O的电离常数Kb= [c(NH4*)·c(OH-)]/c(NH3·H2O)= (0.01 mol·L-1·10-7mol·L-1)/(amol·L-1-0.01 mol·L-1)= 10-9/mol·L-1. [考点分析]化学平衡的移动.焓变.盖斯定律.沉淀溶解平衡有关计算综合考查
网址:http://m.1010jiajiao.com/timu_id_4450120[举报]
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
(1)合成氨反应N2(g)+3H2(g)?2NH3(g),在恒温、恒压条件下向平衡体系中通入氩气,平衡
(2)在25℃下,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,沉淀会分步析出.
首先生成沉淀的离子方程式为
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20)
(3)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应后溶液中
c(NH4+)=c(Cl-).则溶液显
.
(4)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则v(o2)=
查看习题详情和答案>>
(1)合成氨反应N2(g)+3H2(g)?2NH3(g),在恒温、恒压条件下向平衡体系中通入氩气,平衡
左
左
移动(填“向左”、“向右”或“不”);使用催化剂使反应的△H不改变
不改变
(填“增大”、“减小”或“不改变”).(2)在25℃下,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,沉淀会分步析出.
首先生成沉淀的离子方程式为
Cu2++2NH3.H2O=Cu(OH)2↓+2NH4+
Cu2++2NH3.H2O=Cu(OH)2↓+2NH4+
氨水过量后,生成的沉淀会部分溶解,写出溶解沉淀的离子方程式Cu(OH)2+4NH3.H2O=[Cu(NH3)4]2++2OH-+4H2O
Cu(OH)2+4NH3.H2O=[Cu(NH3)4]2++2OH-+4H2O
.(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20)
(3)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应后溶液中
c(NH4+)=c(Cl-).则溶液显
中
中
性(填“酸”、“碱”或“中”),请用含a的代数式表示NH3?H2O的电离常数Kb=| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
(4)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则v(o2)=
0.036
0.036
mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,再次达到平衡后,n(SO3)的取值范围为0.36mol<n(SO3)<0.4mol
0.36mol<n(SO3)<0.4mol
. 运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
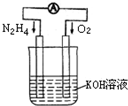
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.(1)发射卫星时可用肼(N2H4)作燃料,其方程式为:
N2H4+O2=N2+2H2O,若将此反应设计成如右图所示的原电池装置,请回答:
①负极反应式为:
N2H4+4OH--4e-=N2+4H2O
N2H4+4OH--4e-=N2+4H2O
;②工作一段时间后正极附近溶液的pH变化为
增大
增大
(填“增大”“减小”或“不变”);③若用该电池电解以石墨为电极的100mL氯化铜溶液,一段时间后,两极均收集到2.24L气体(已换算成标准状况下的体积),则原溶液中Cu2+的物质的量浓度为
0.5 mol?L-1
0.5 mol?L-1
.(2)在25℃时,向浓度均为0.1mol?L-1的MgCl2和CuCl2 混合溶液中逐滴加入氨水,首先生成
Cu(OH)2
Cu(OH)2
沉淀(填化学式),生成该沉淀的离子方程式为Cu2++2NH3?H20=Cu(OH)2↓+2NH4+
Cu2++2NH3?H20=Cu(OH)2↓+2NH4+
.(已知25℃Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20).(3)在25℃时,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显
中
中
性(填“酸”“碱”或“中”),用含a的代数式表示NH3?H2O的电离常数kb=| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
(1)合成氨反应N2(g)+3H2(g)?2NH3(g),若在恒温、恒压条件下,向平衡体系中通入氩气,平衡
(2)一定温度下,在恒容密闭容器中N2O5可发生化学反应:2N2O5(g)?4NO2(g)+O2(g)△H>0
①下表为反应T1温度下的部分实验数据:
则500s内N2O5的分解速率为
②在T2温度下,反应1000s时测得NO2的浓度为4.98mol?L-1,则T2
(3)已知肼分子(H2N-NH2)可以在氧气中燃烧生成氮气和水.
①利用肼、氧气与KOH溶液组成碱性燃料电池,请写出电池负极的电极反应式
②用电离方程式表示肼的水溶液呈碱性的原因
③肼是强还原剂,与氧化剂反应时放出大量的热,如:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-642.2kJ?mol-1因此肼可以作为火箭推进剂.根据上述信息,你认为是否可以通过改变反应条件,由氮气和水蒸气来制取肼
查看习题详情和答案>>
(1)合成氨反应N2(g)+3H2(g)?2NH3(g),若在恒温、恒压条件下,向平衡体系中通入氩气,平衡
向左
向左
移动(填“向左”“向右”或“不”);使用催化剂后反应的△H(填“增大”“减小”或“不改变”)不改变
不改变
.(2)一定温度下,在恒容密闭容器中N2O5可发生化学反应:2N2O5(g)?4NO2(g)+O2(g)△H>0
①下表为反应T1温度下的部分实验数据:
| t/s | 0 | 500 | 1000 |
| C(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
0.00296 mol?L-1?S-1
0.00296 mol?L-1?S-1
.②在T2温度下,反应1000s时测得NO2的浓度为4.98mol?L-1,则T2
<
<
T1(填“>”“<”“=”)(3)已知肼分子(H2N-NH2)可以在氧气中燃烧生成氮气和水.
①利用肼、氧气与KOH溶液组成碱性燃料电池,请写出电池负极的电极反应式
N2H4-4e-+4OH-=N2+4H2O
N2H4-4e-+4OH-=N2+4H2O
;②用电离方程式表示肼的水溶液呈碱性的原因
H2N-NH2?H2O?H2N-NH3++OH-
H2N-NH2?H2O?H2N-NH3++OH-
③肼是强还原剂,与氧化剂反应时放出大量的热,如:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-642.2kJ?mol-1因此肼可以作为火箭推进剂.根据上述信息,你认为是否可以通过改变反应条件,由氮气和水蒸气来制取肼
不可以
不可以
.说明原因因为该反应的逆反应是吸热反应,即△H>0,且熵减小,属于不自发反应,故不能用氮气和水来制取肼
因为该反应的逆反应是吸热反应,即△H>0,且熵减小,属于不自发反应,故不能用氮气和水来制取肼
.运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
(1)合成氨反应N2(g)+3H2(g)?2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
(2)已知:O2(g)═O
(g)+e-△H1=1175.7kJ?mol-1
PtF6(g)+e-═PtF
(g)△H2=-771.1kJ?mol-1
O2PtF6(s)═O
(g)+PtF
(g)△H3=482.2kJ?mol-1
则反应:O2(g)+PtF6(g)═O2PtF6(s)的△H=
(3)已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20.
在25℃下,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
(4)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中c(NH
)=c(Cl-),则溶液显
.
查看习题详情和答案>>
(1)合成氨反应N2(g)+3H2(g)?2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
向左
向左
移动(填“向左”、“向右”或“不”);使用催化剂不改变
不改变
反应的△H(填“增大”“减小”或“不改变”).(2)已知:O2(g)═O
+ 2 |
PtF6(g)+e-═PtF
- 6 |
O2PtF6(s)═O
+ 2 |
- 6 |
则反应:O2(g)+PtF6(g)═O2PtF6(s)的△H=
-78.2
-78.2
kJ?mol-1(3)已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20.
在25℃下,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
Cu(OH)2
Cu(OH)2
沉淀 (填物质的化学式),生成该沉淀的离子方程式为Cu2++2NH3?H2O?Cu(OH)2↓+2NH4+
Cu2++2NH3?H2O?Cu(OH)2↓+2NH4+
.(4)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中c(NH
+ 4 |
中性
中性
性(填“酸”“碱”或“中”);用含a的代数式表示NH3?H2O的电离常数Kb=| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
(1)合成氨反应,在2L密闭容器中通入2mol的N2和6mol的H2,5min时反应达到平衡,此时容器内的压强变为原来的3/4,0-5min该反应的化学反应速率为V(H2)=
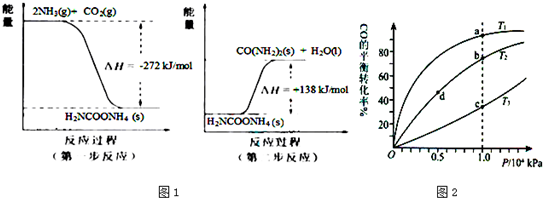
(2)NH3 (g)与CO2(g)经过两步反应生成尿素〔CO(NH2)2〕,两步反应的能量变化示意图1:
则NH3(g) 与CO2(g) 反应生成尿素的热化学方程式为
(3)用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示.下列说法正确的是
A.温度:T1>T2>T3
B.平衡常数:K(a)>K(c)
C.平衡常数:K(b)=K(d)
D.正反应速率:v(b)>v(d)
E.平均摩尔质量:M(a)=M(c)
(4)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中C(NH+4)=C(Cl?),则溶液显(
.
查看习题详情和答案>>
(1)合成氨反应,在2L密闭容器中通入2mol的N2和6mol的H2,5min时反应达到平衡,此时容器内的压强变为原来的3/4,0-5min该反应的化学反应速率为V(H2)=
0.3mol/(L.min)
0.3mol/(L.min)
,N2的转化率=50%
50%
,化学平衡常数K=0.59
0.59
.(2)NH3 (g)与CO2(g)经过两步反应生成尿素〔CO(NH2)2〕,两步反应的能量变化示意图1:
则NH3(g) 与CO2(g) 反应生成尿素的热化学方程式为
2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-134kJ/mol
2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-134kJ/mol
.(3)用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)?CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示.下列说法正确的是
BCD
BCD
(填字母)A.温度:T1>T2>T3
B.平衡常数:K(a)>K(c)
C.平衡常数:K(b)=K(d)
D.正反应速率:v(b)>v(d)
E.平均摩尔质量:M(a)=M(c)
(4)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中C(NH+4)=C(Cl?),则溶液显(
中
中
)性(填“酸”“碱”或“中”);用含a的代数式表示NH3?H2O的电离常数Kb=| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |
