摘要:化学性质 ⑴弱酸性: 俗名 .加入石蕊的现象是什么? ① 酸性的验证:浊液中加入NaOH变澄清 ②酸性强弱及验证: a. 酸性 : b. 弱酸性: 思考: -OH+Na2CO3 → -ONa+NaHCO3 ? -OH+NaHCO3 → -ONa+CO2+H2O ? ⑵取代反应:(易与Br2.HNO3发生苯环H取代.不能发生-OH取代) ①卤代: 注意:a常温下浓溴水即能与苯酚反应.说明苯酚的取代比苯及同系物容易. b此反应常用于苯酚的定性检验.与定量测定. c 的除杂与分离: ②硝化: 2.4.6-三硝基苯酚.俗名:苦味酸.烈性炸药 ⑶显色反应:苯酚+Fe3+→溶液呈紫色(用于Fe3+和 -OH的相互鉴别 ⑷其它反应:氧化反应.缩聚反应.酯化反应
网址:http://m.1010jiajiao.com/timu_id_4449346[举报]
现有部分短周期元素的性质或原子结构如下表:
(1)元素T的原子最外层共有
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒发生水解反应的离子方程式
(3)元素Z与元素T相比,非金属性较强的是
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物水化物中化学性质明显不同于其他三种酸的是
查看习题详情和答案>>
| 元素编号 | 元素性质或原子结构 |
| T | M层p电子数比s电子数多2个 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
6
6
种不同运动状态的电子.写出X原子的电子排布式1s22s22p2
1s22s22p2
.(2)元素Y与氢元素形成一种离子YH4+,写出该微粒发生水解反应的离子方程式
NH4++H2O?NH3?H2O+H+
NH4++H2O?NH3?H2O+H+
.(3)元素Z与元素T相比,非金属性较强的是
Cl
Cl
用元素符号表示),下列表述中能证明这一事实的是b
b
.a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物水化物中化学性质明显不同于其他三种酸的是
H2CO3
H2CO3
,理由是H2CO3为弱酸性或非氧化性酸
H2CO3为弱酸性或非氧化性酸
.(2012?和平区一模)已知:(I)B的产量可以用来衡量-个国家的石油化工发展水平.

有机物A是一种香料化合物,其化学性质稳定,香气柔和清雅,具有新鲜苹果和草莓的香气,广泛用于花香型和果香型香精的调配.其合成过程如下:
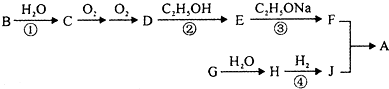
(1)J的相对分子质量为76,不能与NaHCO3溶液反应,1mol J能与足量的Na反应生成1mol H2,J的一氯代物有两种,写出J的结构简式
(2)有机物G中含有一种与B相同的官能团,还能与新制的Cu(OH)2生成红色沉淀,G中的含氧官能团的名称为
(3)写出②的化学反应方程式
(4)反应①、②、④中属于取代反应的是
(5)关于H下列说法正确的是.
a.含有两种不同的官能团
b.能发生银镜反应,与H互为同分异构体的有机物还有一种
c.H可以发生加成反应,消去反应,氧化反应和还原反应
d.H具有弱酸性
(6)E有多种同分异构体.能发生水解反应且能发生银镜反应的同分异构体有
(7)写出制备A的化学方程式:
 .
.
查看习题详情和答案>>

有机物A是一种香料化合物,其化学性质稳定,香气柔和清雅,具有新鲜苹果和草莓的香气,广泛用于花香型和果香型香精的调配.其合成过程如下:

(1)J的相对分子质量为76,不能与NaHCO3溶液反应,1mol J能与足量的Na反应生成1mol H2,J的一氯代物有两种,写出J的结构简式
CH2OHCH2CH2OH
CH2OHCH2CH2OH
.(2)有机物G中含有一种与B相同的官能团,还能与新制的Cu(OH)2生成红色沉淀,G中的含氧官能团的名称为
醛基
醛基
.(3)写出②的化学反应方程式
CH3COOH+C2H5OH
CH3COOC2H5+H2O
| 浓硫酸 |
| △ |
CH3COOH+C2H5OH
CH3COOC2H5+H2O
.| 浓硫酸 |
| △ |
(4)反应①、②、④中属于取代反应的是
②
②
.(5)关于H下列说法正确的是.
a.含有两种不同的官能团
b.能发生银镜反应,与H互为同分异构体的有机物还有一种
c.H可以发生加成反应,消去反应,氧化反应和还原反应
d.H具有弱酸性
(6)E有多种同分异构体.能发生水解反应且能发生银镜反应的同分异构体有
2
2
种,写出其中一种核磁共振氢谱有四个峰,且峰面积之比为1:2:2:3的同分异构体的结构简式HCOOCH2CH2CH3
HCOOCH2CH2CH3
.(7)写出制备A的化学方程式:


 (2010?烟台一模)2008年5月12日我国四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒液,如NaClO溶液.某校探究性学习小组对消毒液次氯酸钠(NaClO)的制备与性质等进行了探究.
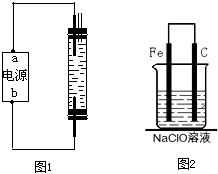
(2010?烟台一模)2008年5月12日我国四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒液,如NaClO溶液.某校探究性学习小组对消毒液次氯酸钠(NaClO)的制备与性质等进行了探究.甲同学:为制备消毒液,探究并制作了一种家用环保型消毒液(NaClO溶液)发生器,设计了如图1所示的装置,用石墨作电极电解饱和氯化钠溶液.
请完成下列问题:若通电时,为使生成的Cl2被完全吸收,制得有较强杀菌能力的消毒液,则电源的a电极名称为
负
负
极(填“正”、“负”、“阴”或“阳”),与其相连的电极的电极反应式为2H++2e-→H2↑
2H++2e-→H2↑
;装置溶液中反应生成NaClO的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O
Cl2+2OH-═Cl-+ClO-+H2O
.乙同学:从某超市中查询到某品牌消毒液包装说明的部分内容摘录如下:
主要有效成份为次氯酸钠,有效氯含量8000-10000mg/L.可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用.切勿用于丝绸、毛、尼龙、皮革、油漆表面,勿用于铝、铜、碳钢制品.本品须密封,置阴凉暗处保存.
请完成以下实验探究过程:
Ⅰ.阅读材料,根据学过的知识判断问题
(1)室温条件下,该消毒液(NaClO)溶液的pH
>
>
7(填“>”、“<”或“=”),原因是(用离子方程式表示)
ClO-+H2O?HClO+OH-
ClO-+H2O?HClO+OH-
.(2)该消毒液还具有的化学性质是
A、D
A、D
(填序号).A.强氧化性 B.强还原性 C.不稳定性 D.漂白性 E.弱酸性
Ⅱ.确定要研究的问题
该消毒液对碳钢制品的腐蚀原理.
Ⅲ.设计方案,实施探究
(1)用烧杯取少量样品,将一颗光亮的普通碳钢钉放入烧杯,浸泡一段时间.预期的实验现象是
钢钉表面有红褐色物质生成
钢钉表面有红褐色物质生成
.(2)为了进一步探究碳钢钉在该消毒液(NaClO)中的腐蚀原理,丁同学设计了如图2实验装置,写出碳(C)极上发生的电极反应式
ClO-+2e-+H2O→Cl-+2OH-
ClO-+2e-+H2O→Cl-+2OH-
.现有部分短周期元素的性质或原子结构如下表:
(1)写出元素X的离子结构示意图
 .写出元素Z的气态氢化物的电子式
.写出元素Z的气态氢化物的电子式
 (用元素符号表示)
(用元素符号表示)
(2)写出Y元素最高价氧化物水化物的电离方程式
(3)元素T与氯元素相比,非金属性较强的是
a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入氯化钠水溶液不能置换出氯气
c.氯与T形成的化合物中氯元素呈正价态
(4)探寻物质的性质差异性是学习的重要方法之-.T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是
查看习题详情和答案>>
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | L层p电子数比s电子数多2个 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | L层有三个未成对电子 |




(2)写出Y元素最高价氧化物水化物的电离方程式
H++AlO2-+H2O Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-
 Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-H++AlO2-+H2O Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-
. Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-(3)元素T与氯元素相比,非金属性较强的是
F
F
(用元素符号表示),下列表述中能证明这一事实的是c
c
.a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入氯化钠水溶液不能置换出氯气
c.氯与T形成的化合物中氯元素呈正价态
(4)探寻物质的性质差异性是学习的重要方法之-.T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是
Al
Al
,理由具有金属性
具有金属性
.(1)硫元素有多种化合价,可形成多种化合物.填写下表中的空白:
(2)已知NaHSO3溶液显弱酸性,请写出该溶液中存在的各种平衡反应的离子方程式:
(3)请按照浓度由大到小的顺序排列Na2SO3溶液中的离子:
Na2SO3溶液放置于空气中一段时间后,溶液的pH
(4)某同学设计如下实验流程探究Na2S2O3的化学性质.

实验①可说明Na2S2O3能发生水解,实验②③说明Na2S2O3具有
查看习题详情和答案>>
| 化合价 | -2 | -1 | 0 | +2 | +4 | +6 | +7 |
| 代表物的化学式 | Na2S等 Na2S等 |
FeS2 | S | Na2S2O3 | SO2等 SO2等 |
SO3或H2SO4或Na2SO4 | Na2S2O8 |
H2O?H++OH-、HSO3-?H++SO32-、HSO3-+H2O?H2SO3+OH-
H2O?H++OH-、HSO3-?H++SO32-、HSO3-+H2O?H2SO3+OH-
.(3)请按照浓度由大到小的顺序排列Na2SO3溶液中的离子:
c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
.Na2SO3溶液放置于空气中一段时间后,溶液的pH
减小
减小
(填“增大”“减小”或“不变”).(不考虑水的蒸发)原因是SO32-被氧化生成SO42-,SO32-的浓度减小,水解产生的OH-浓度减小,溶液pH减小,
SO32-被氧化生成SO42-,SO32-的浓度减小,水解产生的OH-浓度减小,溶液pH减小,
.(4)某同学设计如下实验流程探究Na2S2O3的化学性质.

实验①可说明Na2S2O3能发生水解,实验②③说明Na2S2O3具有
还原性
还原性
性.请你预测Na2S2O3还可能具有的化学性质(列举2条即可)具有氧化性、还原性
具有氧化性、还原性
、可能发生歧化反应
可能发生歧化反应
.