网址:http://m.1010jiajiao.com/timu_id_4447505[举报]
【实验一】:测定硫元素的含量
I.将m1g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全得到红棕色固体和一种刺激性气味的气体.写出石英管中发生反应的化学方程式为:
| ||
| ||

Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:

问题讨论:
(1)I中,甲中所盛试剂是
(2)Ⅱ中,所加H2O2溶液需足量的理由是
发生反应的离子方程式为
(3)该黄铁矿石中硫元素的质量分数为
| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |
【实验二】:设计以下实验方案测定铁元素的含量

问题讨论:
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有
(6)某同学一共进行了三次滴定实验,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 26.42 | 25.05 | 24.95 |
实验室中常用中和滴定、氧化还原滴定等方法测定未知浓度的某反应物的物质的量浓度或测定其样品的纯度.
(1)请回答有关指示剂选用的问题
①用已知浓度的盐酸滴定未知浓度的NaOH溶液时,应选择________作指示剂.
②用已知浓度的盐酸滴定未知浓度的![]() 溶液且最终生成
溶液且最终生成![]() 时,应选择________指示剂.
时,应选择________指示剂.
③用已知浓度的![]() 溶液滴定未知浓度的碘水时,应选择________作指示剂.
溶液滴定未知浓度的碘水时,应选择________作指示剂.
④用已知浓度的![]() 溶液滴定未知浓度的硫酸亚铁酸性溶液时,应________指示剂.原因是________.
溶液滴定未知浓度的硫酸亚铁酸性溶液时,应________指示剂.原因是________.
(2)用已知浓度的盐酸滴定未知浓度的稀NaOH溶液时,为减小滴定误差,在选用盐酸的物质的量浓度和体积时,下列四个选项中最佳的是
[ ]
实验实中常用中和滴定、氧化还原滴定等方法测定未知浓度的某反应物的物质的量浓度或测定某样品的纯度.
(1)请回答下列关于指示剂的选用问题:
①用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,应选择________作指示剂.
②用已知浓度的盐酸滴定未知浓度的碳酸钠溶液且最终生成二氧化碳时,应选择________作指示剂.
③用已知浓度的硫代硫酸钠滴定未知浓度的碘水时,应选择________作指示剂.(有关反应的化学方程式为2Na2S2O3+I2![]() Na2S4O6+2NaI)
Na2S4O6+2NaI)
④用已知浓度的高锰酸钾溶液滴定未知浓度的硫酸亚铁酸性溶液时应________指示剂,原因是________.
(2)用已知浓度的盐酸滴定未知浓度的稀氢氧化钠溶液时,为减小滴定误差,在选用盐酸的物质的量浓度和体积时,下列四个选项中最佳的是________(填选项字母).
[ ]
(3)已知基准物是某些纯度高、稳定性好的物质.可在准确称量其质量后直接配制成标准溶液并标定溶液浓度.现有用浓盐酸新配制出的标准溶液,由于________(填写原因)使得浓度不很精确.该盐酸在使用前,需用基准物进行标定.实验室标定标准的盐酸一般选用纯净的无水碳酸钠作基准物.
①上述基准物能否改用纯净的氢氧化钠固体_________(“能”或“不能”);简述理由________.
②某学生误将一种不纯的碳酸钠样品作基准物,则所测得的盐酸浓度将________(填偏高、偏低、无法确定、不受影响).
查看习题详情和答案>>将m1g该黄铁矿石的样品放入如下图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全.其反应的化学方程式为:
4FeS2+11O2
| ||
4FeS+7O2
| ||
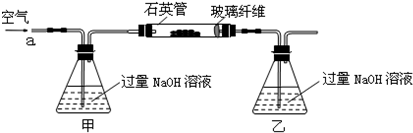
实验一:测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:
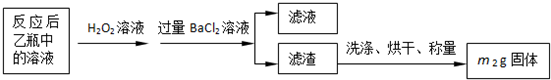
(1)甲、乙两装置的作用分别是
乙瓶内发生反应的离子方程式为
(2)反应后乙瓶中的溶液需加足量H2O2溶液的目的是
(3)该黄铁矿石中硫元素的质量分数为
| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |
实验二:测定铁元素的含量
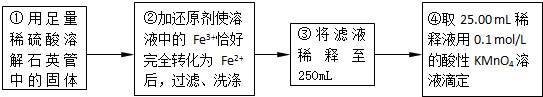
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有
(6)某同学一共进行了三次滴定实验,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 24.97 |
(13分)平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵:
已知:
ⅰ.酸性条件下,铈在水溶液中有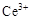 、
、 两种主要存在形式,
两种主要存在形式,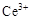 易水解,
易水解, 有较强氧化性。
有较强氧化性。
ⅱ.CeO2不溶于稀硫酸
ⅲ.硫酸铁铵[aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于水的净化处理。
(1).操作Ⅰ的名称是 ,检验硫酸铁铵溶液中含有NH4+的方法是: 。
(2).反应①之前先要洗涤滤渣B,其目的是为了除去 (填离子符号)。
(3).写出反应①的化学方程式 。
(4).用滴定法测定制得的Ce(OH)4产品纯度。
滴定时所用定量仪器的读数精确为 ;若所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则测得该Ce(OH)4产品的质量分数 。(填“偏大”、“偏小”或“无影响”)
(5).称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应。则该硫酸铁铵的化学式为 。