摘要:(三)本节教材的主要特点 1.理论联系实际.铝.金.银.铜等常见金属是学生在生产生活中经常碰到的物质.学生感性认识丰富.有探究的欲望和兴趣. 2.应用分类的思想和研究物质性质的方法来研究具体物质的性质.突出过程与方法的训练.
网址:http://m.1010jiajiao.com/timu_id_4435157[举报]
(2012?江苏一模)三聚磷酸钠(Na5P3O10)是一种优异的清洁剂添加剂.一种以黄磷(着火点40℃)为原料生产三聚磷酸钠的主要工艺如下:
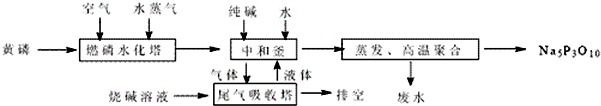
(1)工业上黄磷放在铁桶中加水封盛装,其目的是
(2)在三聚磷酸钠的生产过程中,有大量的含磷废水产生,经过处理后才排放,其目的是
(3)上述工艺中,循环使用的物料除各种冷却水外,还有
(4)在中和釜中按计量比生成磷酸的两种酸式盐.这两种酸式盐在高温聚合时可生成三聚磷酸钠和另一种产物,该反应的化学方程式为
查看习题详情和答案>>

(1)工业上黄磷放在铁桶中加水封盛装,其目的是
防止黄磷在空气中氧化
防止黄磷在空气中氧化
;燃磷时,通入足量的空气,其目的是使黄磷充分氧化
使黄磷充分氧化
.(2)在三聚磷酸钠的生产过程中,有大量的含磷废水产生,经过处理后才排放,其目的是
减少磷资源流失(充分利用磷资源)
减少磷资源流失(充分利用磷资源)
;防止含磷废水引发水体富营养化(水体组成严重污染)
防止含磷废水引发水体富营养化(水体组成严重污染)
.(3)上述工艺中,循环使用的物料除各种冷却水外,还有
碳酸钠溶液
碳酸钠溶液
.(4)在中和釜中按计量比生成磷酸的两种酸式盐.这两种酸式盐在高温聚合时可生成三聚磷酸钠和另一种产物,该反应的化学方程式为
2Na2HPO4+NaH2PO4
Na5P3O10+10H2O
| ||
2Na2HPO4+NaH2PO4
Na5P3O10+10H2O
.
| ||
I.在足量的氯化亚铁溶液中加入少量(1-2滴)液溴,振荡后溶液变为黄色.
(1)甲同学认为是Br2单质溶于水变成黄色溶液;乙认为是Fe2+被氧化成Fe3+使溶液变成黄色.
(2)请根据提供试剂作出判断:
试剂:A 酸性高锰酸钾溶液 B 氢氧化钠溶液 C 四氯化碳 D 硫氰化钾溶液
判断:两个同学的观点中正确的是
(3)在FeCl3溶液中加入淀粉碘化钾溶液,能观察到的实验现象是
Ⅱ.若要把溶解于水中的Br2单质分离出来,所需要的主要玻璃仪器是
查看习题详情和答案>>
(1)甲同学认为是Br2单质溶于水变成黄色溶液;乙认为是Fe2+被氧化成Fe3+使溶液变成黄色.
(2)请根据提供试剂作出判断:
试剂:A 酸性高锰酸钾溶液 B 氢氧化钠溶液 C 四氯化碳 D 硫氰化钾溶液
判断:两个同学的观点中正确的是
乙
乙
(填“甲”或“乙”),并用两种方法(原理不同)加以试验证明,写出选用的试剂编号及实验中观察到的现象:| 选用试剂 | 实验现象 | |
| 第一种方法 | ||
| 第二种方法 |
溶液变蓝
溶液变蓝
.若选用淀粉碘化钾溶液来试验某观点的推断正确,你认为是否可行?不可行
不可行
;若可行本问不需要回答,若不可行请说明原因:因为溴单质和三价铁均可以将碘离子氧化为单质
因为溴单质和三价铁均可以将碘离子氧化为单质
.Ⅱ.若要把溶解于水中的Br2单质分离出来,所需要的主要玻璃仪器是
分液漏斗
分液漏斗
,该操作的名称是萃取
萃取
.
某化学小组在学习元素周期律后,对教材中Fe2+氧化为Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化为Fe3+,那么Br2和I2能否将Fe2+氧化为Fe3+?
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是 .
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为Fe3+而I2不能.他们思考的依据是从上到下卤素单质氧化性减弱.
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10mL 稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验.
实验1:
环节三:实验现象的分析与解释
(1)同学甲认为①中现象说明溴水能将Fe2+氧化,离子方程式为 .
同学乙认为应该补充实验,才能得出同学甲的结论.请你帮助同学乙完成实验:
实验2:
(2)该小组同学对②中溶液呈黄色的原因展开了讨论:
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色.
可能2: .
实验3:进行实验以确定可能的原因.
同学丙认为该实验现象可以说明是“可能2”成立,同学丁认为不严谨,于是设计了实验4:
实验4:
你认为实验4设计的主要目的是 .
同学丁根据实验4现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小.
(3)Cl2、Br2、I2氧化Fe2+ 的能力逐渐减弱,用原子结构解释原因: .
查看习题详情和答案>>
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为Fe3+而I2不能.他们思考的依据是从上到下卤素单质氧化性减弱.
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10mL 稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验.
实验1:
| 试管 | 操作 | 现象 |
| ① | 先向试管中加入2mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
| ② | 先向试管中加入2mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
(1)同学甲认为①中现象说明溴水能将Fe2+氧化,离子方程式为
同学乙认为应该补充实验,才能得出同学甲的结论.请你帮助同学乙完成实验:
实验2:
| 操作 | 应该观察到的现象 |
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色.
可能2:
实验3:进行实验以确定可能的原因.
| 操作 | 现象 |
| 向试管②所得溶液中继续加入0.5mLCCl4,充分振荡,静置一段时间后.取出上层溶液,滴加KSCN 溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN 溶液后,出现浅红色 |
实验4:
| 操作 | 现象 |
| 向另一支试管中加入2mL FeCl2溶液,滴加0.5mL碘水后,再加入0.5mL 乙酸乙酯,充分振荡,静置一段时间后.取出下层溶液,滴加KSCN 溶液 | 静置后,上层液为紫色,下层液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
同学丁根据实验4现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小.
(3)Cl2、Br2、I2氧化Fe2+ 的能力逐渐减弱,用原子结构解释原因:
(一)括号中的物质是杂质,写出除去这些杂质的试剂:
(1)MgO (Al2O3)
(3)FeCl3(FeCl2)
(二)海水中含有大量的氯化镁,从海水中提取镁的生产流程如图1所示:
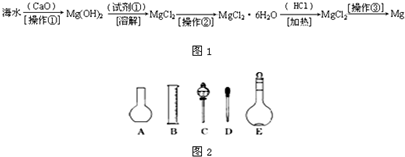
回答下列问题:
写出在海水中加入氧化钙生成氢氧化镁的化学方程式
操作①主要是指
(三)实验室配制480ml 0.1mol?L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取十水碳酸钠晶体
(2)如图2所示的仪器配制溶液肯定不需要的是
(3)容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的
(4)配制所需的主要仪器是:a容量瓶、b烧杯、c胶头滴管、d托盘天平,它们在操作过程中使用的前后顺序是
(5)玻璃棒是化学实验中常用的一种玻璃工具,则在配制溶液的过程中玻璃棒共起到了
(6)若实验时遇到下列情况,将使溶液的浓度偏低的是
A.配制前设有将容量瓶中的水除尽; B.碳酸钠失去了部分结晶水;
C.碳酸钠晶体不纯,其中混有氯化钠; D.称量碳酸钠晶体时所用砝码生锈; E.定容时仰视刻度线.
查看习题详情和答案>>
(1)MgO (Al2O3)
NaOH溶液
NaOH溶液
(2)Cl2(HCl)饱和NaCl溶液
饱和NaCl溶液
(3)FeCl3(FeCl2)
氯气或氯水
氯气或氯水
(4)NaHCO3溶液(Na2CO3)CO2
CO2
(二)海水中含有大量的氯化镁,从海水中提取镁的生产流程如图1所示:

回答下列问题:
写出在海水中加入氧化钙生成氢氧化镁的化学方程式
CaO+MgCl2+H2O=Mg(OH)2+CaCl2
CaO+MgCl2+H2O=Mg(OH)2+CaCl2
;操作①主要是指
过滤
过滤
;试剂①可选用HCl
HCl
;操作②是指蒸发浓缩,冷却结晶,过滤
蒸发浓缩,冷却结晶,过滤
;经操作③最终可得金属镁.(三)实验室配制480ml 0.1mol?L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取十水碳酸钠晶体
14.3
14.3
g.(2)如图2所示的仪器配制溶液肯定不需要的是
AC
AC
(填序号),本实验所需玻璃仪器E规格为500
500
mL.(3)容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的
①③⑤
①③⑤
.(填数字符号)(4)配制所需的主要仪器是:a容量瓶、b烧杯、c胶头滴管、d托盘天平,它们在操作过程中使用的前后顺序是
dbac
dbac
.(填写字母,每种仪器只能选择一次)(5)玻璃棒是化学实验中常用的一种玻璃工具,则在配制溶液的过程中玻璃棒共起到了
2
2
种用途.(填写数字)(6)若实验时遇到下列情况,将使溶液的浓度偏低的是
CE
CE
.A.配制前设有将容量瓶中的水除尽; B.碳酸钠失去了部分结晶水;
C.碳酸钠晶体不纯,其中混有氯化钠; D.称量碳酸钠晶体时所用砝码生锈; E.定容时仰视刻度线.