摘要:第1课时 [复习引入]在物质的分类中.我们将纯净物分为单质及化合物.而化合物又可分为氧化物.酸.碱.盐等: 而化合物还有另外一种分类方法.即根据在水溶液或熔融下能否导电.又可以将化合物分为电解质和非电解质.从本节课开始.我们将学习有关电解质的知识. [板书] 第2节 电解质
网址:http://m.1010jiajiao.com/timu_id_4434945[举报]
某岛屿引入外来物种野兔,研究人员调查了30年间野兔种群数量的变化,并据此绘制了λ值变化曲线。以下叙述正确的是
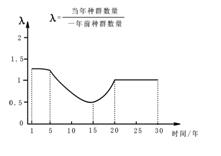
A.第1年至第5年间野兔种群数量保持相对稳定
B.第5年起野兔种群数量开始下降
C.第15年至第20年间野兔种群数量呈“J”型增长
D.第20年到第30年间野兔种群数量的增长率为0
查看习题详情和答案>>(2012?天津模拟)某研究小组欲探究SO2的化学性质,设计了如下实验方案.
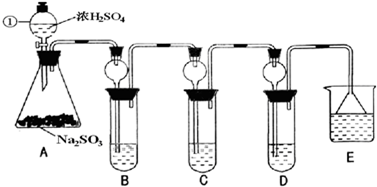
(1)指出仪器①的名称
(2)检查A装置的气密性的方法是
(3)装置B检验SO2的氧化性,则B中所盛试剂可以为
(4)装置C中盛装溴水用以检验SO2的
(5)装置D中盛装新制漂白粉浓溶液通入SO2一段吋间后,D中出现了大量白色沉淀.同学们对白色沉淀成分提出三种假设:
①假设一:该白色沉淀为CaSO3
假设二:该白色沉淀为
假设三:该白色沉淀为上述两种物质的混合物.
②基于假设一,同学们对白色沉淀成分进行了探究.设计如下方案:
限选的仪器和试剂;过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5mol.L-1 HCl、0.5mol.L-1 H2SO4、0.5mol.L-1BaCl2、1mol.L-1 NaOH、品红溶液.
第1步,将D中沉淀过滤、洗涤干净,备用.
请回答洗涤沉淀的方法:
第2步,用另一只干净试管取少量沉淀样品,加入
若出现
③若假设二成立,试写出生成该白色沉淀的化学方程式:
(6)装置E中盛放的试剂是
查看习题详情和答案>>

(1)指出仪器①的名称
分液漏斗
分液漏斗
.(2)检查A装置的气密性的方法是
关闭分液漏斗活塞,将导管末端插入B试管水中,用手捂住锥形瓶,若在导管口有气泡冒出,松开手后导管中上升一段水柱,则表明装置A气密性良好
关闭分液漏斗活塞,将导管末端插入B试管水中,用手捂住锥形瓶,若在导管口有气泡冒出,松开手后导管中上升一段水柱,则表明装置A气密性良好
.(3)装置B检验SO2的氧化性,则B中所盛试剂可以为
硫化氢水溶液(或硫化钠、硫氢化钠溶液均可)
硫化氢水溶液(或硫化钠、硫氢化钠溶液均可)
.(4)装置C中盛装溴水用以检验SO2的
还原
还原
性,则C中反应的离子方程式为SO2+Br2+2H2O=SO42-+4H++2Br-
SO2+Br2+2H2O=SO42-+4H++2Br-
.(5)装置D中盛装新制漂白粉浓溶液通入SO2一段吋间后,D中出现了大量白色沉淀.同学们对白色沉淀成分提出三种假设:
①假设一:该白色沉淀为CaSO3
假设二:该白色沉淀为
CaSO4
CaSO4
.假设三:该白色沉淀为上述两种物质的混合物.
②基于假设一,同学们对白色沉淀成分进行了探究.设计如下方案:
限选的仪器和试剂;过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5mol.L-1 HCl、0.5mol.L-1 H2SO4、0.5mol.L-1BaCl2、1mol.L-1 NaOH、品红溶液.
第1步,将D中沉淀过滤、洗涤干净,备用.
请回答洗涤沉淀的方法:
沿玻璃棒向漏斗中加蒸馏水至浸没沉淀,待水流尽后重复2~3次以上操作
沿玻璃棒向漏斗中加蒸馏水至浸没沉淀,待水流尽后重复2~3次以上操作
.第2步,用另一只干净试管取少量沉淀样品,加入
过量(或适量)0.5mol.L-1HCl、
过量(或适量)0.5mol.L-1HCl、
(试剂),塞上带导管的单孔塞,将导管的另一端插入盛有品红溶液
品红溶液
(试剂)的试管中.若出现
若固体完全溶解,有气泡产生,且能使品红溶液褪色
若固体完全溶解,有气泡产生,且能使品红溶液褪色
现象,则假设一成立.③若假设二成立,试写出生成该白色沉淀的化学方程式:
Ca(ClO)2+H2O+SO2=CaSO4+2HCl
Ca(ClO)2+H2O+SO2=CaSO4+2HCl
.(6)装置E中盛放的试剂是
NaOH溶液
NaOH溶液
,作用是吸收SO2,防止造成空气污染
吸收SO2,防止造成空气污染
. 高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.(1)高锰酸钾溶液应
(2)请配平高锰酸钾溶液与草酸钠Na2C2O4溶液在酸性条件下反应的离子方程式:MnO4-+C2O42-+H+--Mn2++CO2↑+
(3)某学习小组为了探究高锰酸钾溶液和草酸钠溶液的反应过程,将高锰酸钾溶液逐滴地滴入一定体积的酸性草酸钠溶液中(温度相同,并不断振荡时),记录的现象如下表:
| 滴入高锰酸钾溶液的次序(每滴溶液的体积相同) | 高锰酸钾溶液紫色褪去的时间 |
| 先滴入第1滴 | 1min |
| 褪色后再滴入第2滴 | 15s |
| 褪色后再滴入第3滴 | 3s |
| 褪色后再滴入第4滴 | 1s |
(4)该学习小组在获取了上述经验和结论以后,用稳定的物质草酸钠Na2C2O4(相对分子质量134.0)来标定高锰酸钾溶液的浓度.他们准确称取1.340g纯净的草酸钠配成250mL溶液,每次准确量取25.00mL溶液酸化后用KMnO4溶液滴定.
①高锰酸钾溶液应装在
②为了防止高锰酸钾在酸性条件下分解而造成误差,滴定开始时,操作上必须是
③当溶液呈微红色且半分钟内不褪色,消耗KMnO4溶液20.00mL(多次测定的平均值),则KMnO4溶液的浓度为
有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验.通入SO2气体,将带火星的木条插入试管C中,木条复燃.请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3.
(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成.为检验是否有Na2SO4生成,他们设计了如下方案:上述方案是否合理?
查看习题详情和答案>>

(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是
2Na2O2+2SO2═2Na2SO3+O2
2Na2O2+2SO2═2Na2SO3+O2
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3.
取白色固体,加稀硫酸,产生能使品红溶液褪色的气体
取白色固体,加稀硫酸,产生能使品红溶液褪色的气体
.(3)第2小组同学认为Na2O2与SO2反应除了生成Na2SO3和O2外,还有Na2SO4生成.为检验是否有Na2SO4生成,他们设计了如下方案:上述方案是否合理?
不合理
不合理
.请简要说明两点理由:①稀硝酸能将亚硫酸钡氧化为硫酸钡
稀硝酸能将亚硫酸钡氧化为硫酸钡
;②如果反应后的固体中还残留Na2O2也可将亚硫酸钡氧化为硫酸钡.
如果反应后的固体中还残留Na2O2也可将亚硫酸钡氧化为硫酸钡.
.