摘要:(五)信息启发 许多化学试题给解题者提供大量.错综复杂的信息.捕捉有用信息.排除干扰信息.是解决问题的要害.教师应着力点拨学生将隐蔽的弱信息挖掘出来.以补充解题信息不足.确保解题通畅.并识别干扰信息.确保解题正确.试看一错误率很高的上海高考试题:浅绿色的Fe(NO3)2 溶液中存在着如下平衡: Fe2+ +2H2O Fe(OH)2 +2H+ 若在此溶液中加入盐酸.溶液的颜色是变深.变浅.不变.变黄四个选项.很多学生误选变深.这时我启发学生对题目重新审阅.在题目所给的平衡反应式之后.有没有隐含着什么?同学们恍然大悟. Fe2+ . NO3- . H+ 三者之间要发生氧化还原反应.启发之后.有的同学为自己审题不细而懊悔.有的却陷入了沉思中.这说明.教师要细心体会学生思维的触发点.巧妙启发.可以收到很好的教学效果.
网址:http://m.1010jiajiao.com/timu_id_4430958[举报]
已知A、B、C、D、E五种元素属于周期表中前四周期元素,其核电荷数依次增大.A原子 的2p轨道半充满;B单质在空气中燃烧,生成一种淡黄色固体;C元素是地壳中含量最 高的金属元素;D单质晶体的熔点在同周期元素形成的单质中最高;E原子核外最外层 电子数与B相同,内层均充满.根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为(用元素符号表示) ;E基态原子核外电子排布式为 .
(2)A、D的简单氢化物稳定性较大的为(用化学式表示,下同) ;B的氯化物熔点比D的氯化物熔点 (填高或低),理由是 .
(3)C的氧化物与B的最髙氧化物的水化物反应的离子方程式为 .
(4)火箭中常用A2H4作燃料,AO2作助燃剂,已知0.25molA2H4 (g)在AO2中燃烧生成 一种无污染的气体液态水,放出70.95kJ热量,则该反应的热化学方程式为 .
查看习题详情和答案>>
(1)A、B、C、D的第一电离能由小到大的顺序为(用元素符号表示)
(2)A、D的简单氢化物稳定性较大的为(用化学式表示,下同)
(3)C的氧化物与B的最髙氧化物的水化物反应的离子方程式为
(4)火箭中常用A2H4作燃料,AO2作助燃剂,已知0.25molA2H4 (g)在AO2中燃烧生成 一种无污染的气体液态水,放出70.95kJ热量,则该反应的热化学方程式为
A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:
(1)写出上述一种元素与氢元素形成的X2Y2型非极性分子的结构式:
(2)写出E元素的元素符号: ,其价电子排布图为:
(3)A与D形成化合物的化学式为 ,是 分子(填“极性”或“非极性”)
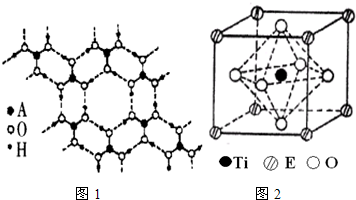
(4)A的最高价氧化物的水化物(H3AO3)是一种白色片层结构的晶体,层内的H3AO3分子间有序排列如
图1所示.在H3AO3晶体中层内分子之间的作用力是 ,该晶体属于 晶体.
(5)在ETiO3晶胞中(结构如图2所示),1个Ti原子和1个E原子周围距离最近的O原子数目分别为 个、 个.
(6)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-.N3-的空间构型为 ,叠氮化物能与E3+形成配合物,则[E(N3)(NH3)5]SO4中配体是 ,E的配位数是 .
查看习题详情和答案>>
| 元素 | 相关信息 |
| A | A的第一电离能低于同周期左右相邻元素 |
| B | B原子中成对电子数等于未成对电子数的2倍 |
| C | C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键 |
| D | D与A、B、C均不同周期,其一个单质分子中只有一个σ键 |
| E | E的原子序数比所处周期中未成对电子数最多的元素大3 |
(2)写出E元素的元素符号:
(3)A与D形成化合物的化学式为

(4)A的最高价氧化物的水化物(H3AO3)是一种白色片层结构的晶体,层内的H3AO3分子间有序排列如
图1所示.在H3AO3晶体中层内分子之间的作用力是
(5)在ETiO3晶胞中(结构如图2所示),1个Ti原子和1个E原子周围距离最近的O原子数目分别为
(6)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-.N3-的空间构型为
五种短周期元素的原子结构及相关物质性质的信息如下表:
请根据信息回答下列问题:
(1)E元素位于周期表第 周期第 族.B元素原子的电子排布式为 .B与C按物质的量1:1形成的化合物的电子式为 .
(2)A、D两种元素形成的化合物的空间构型为 ;它与A、B、C三种元素形成的化合物反应,除水外,还可以生成 和 .
(3)A与B、D、E分别形成的常见化合物属于 晶体,其中熔沸点最高的是 (用化学式表示)
查看习题详情和答案>>
| A | B | C | D | E | |
| 原子结构 | 失去电子后变成质子, | 最外层电子数是次外层电子数的3倍. | L层电子数等于K层和M层电子数之和. | 最外层电子排布为(n+1)sn(n+1)p(n+3). | |
| 物质性质 | 其最高价氧化物对应水化物的碱性是短周期元素中最强的. |
(1)E元素位于周期表第
(2)A、D两种元素形成的化合物的空间构型为
(3)A与B、D、E分别形成的常见化合物属于
(2011?宣城二模)现有前20号的A、B、C、D、E五种元素,相关信息于下表:
(1)B的核外电子排布式为
(2)B、C、D三元素的电负性大小顺序为
(3)C的氢化物的空间构型为
(4)E2D的水溶液呈
(5)已知:12.8g液态C2A4与足量A2O2反应生成C2和气态A2O,放出256.65kJ的热量.
A2O (l)═A2O (g)△H=+44kJ?mol-1.
2A2O2 (l)═2A2O (l)+O2(g)△H=-196.4kJ?mol-1.
则液态C2A4与足量O2反应生成C2和液态A2O的热化学方程式为:
查看习题详情和答案>>
| 元素 | 信息 |
| A | 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B | B原子得一个电子后2p轨道全满 |
| C | C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大 |
| D | D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于其中子数 |
| E | E+和B-具有相同的电子层结构 |
1s22s22p5
1s22s22p5
,CB3的晶体类型为分子晶体
分子晶体
.(2)B、C、D三元素的电负性大小顺序为
F
F
>N
N
>S
S
(填元素符号).(3)C的氢化物的空间构型为
三角锥形
三角锥形
,其氢化物在同族元素所形成的氢化物中沸点最高的原因是氨分子间形成氢键
氨分子间形成氢键
.(4)E2D的水溶液呈
碱性
碱性
(填“酸性”、“碱性”或“中性”),用离子方程式解释理由:S2-+H2O?HS-+OH-
S2-+H2O?HS-+OH-
.(5)已知:12.8g液态C2A4与足量A2O2反应生成C2和气态A2O,放出256.65kJ的热量.
A2O (l)═A2O (g)△H=+44kJ?mol-1.
2A2O2 (l)═2A2O (l)+O2(g)△H=-196.4kJ?mol-1.
则液态C2A4与足量O2反应生成C2和液态A2O的热化学方程式为:
N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=-662.025kJ?mol-1
N2H4(l)+O2(g)═N2(g)+2H2O(l)△H=-662.025kJ?mol-1
. 现有五种1~20号元素组成A~I纯净物(试剂X除外),转化关系如下
现有五种1~20号元素组成A~I纯净物(试剂X除外),转化关系如下相关信息有;①反应④产生白色沉淀,且M(H):143.5g/mol;
②常温下,A、I都是气态单质,且A和I的一种同素异形体都能使湿润的有色布条褪色且都能用于饮用水消毒.
③1molB含28mole-,反应③属于分解反应.
④C是由第三周期的两种元素组成原子个数比为1:3型化合物.
(1)B的电子式为


硝酸银溶液
硝酸银溶液
.反应②离子方程式:4OH-+Al3+=AlO2-+2H2O
4OH-+Al3+=AlO2-+2H2O
.(2)写出反应③的化学方程式:
2KClO3
2KCl+3O2↑
| ||
| △ |
2KClO3
2KCl+3O2↑
;上述所有物质形成的晶体类型有
| ||
| △ |
分子晶体、离子晶体
分子晶体、离子晶体
(选填:分子晶体、离子晶体、原子晶体)(3)C溶液中阴离子浓度与阳离子浓度之比
大于
大于
3(填:大于、小于或等于);简述实验室用C晶体配制3mol/L的C溶液的操作方法是取一定量氯化铝晶体溶于一定量较浓的盐酸中,加蒸馏水稀释至3mol/L的氯化铝溶液
取一定量氯化铝晶体溶于一定量较浓的盐酸中,加蒸馏水稀释至3mol/L的氯化铝溶液
.(4)写出G与C溶液混合的离子方程式
Al3++3AlO2-+6H2O=4Al(OH)3↓
Al3++3AlO2-+6H2O=4Al(OH)3↓
.