摘要:(1)质量守恒定律 参加反应的各种物质的质量总和等于反应后生成的各物质的质量总和.这一定律是书写化学方程式和化学计算的依据. 例5:m molC2H2跟n molH2在密闭容器中反应.当其达到平衡时.生成p mol C2H4.将平衡混合气体完全燃烧生成CO2和H2O.所需氧气的物质量是 A.3m+n B.5/2m+n/2-p/3 C.3m+n+2p D.5m/2+n/2 解析:本题如果按传统的方法也能得出正确结果.但费时多.而利用质量守恒定律解题快而简洁.C~CO2~O2. 4H~2H2O~O2 因此.m molC2~2m molO2 /4 mol O2 总氧气量:2m+/4=5m/2+n/2 答案为D. (2)阿佛加德罗定律 在相同温度和压强下.同体积的任何气体都含有相同数目的分子. 阿佛加德罗定律的应用: ①标准状况下气体的体积(L)=22.4mol/L×物质的量(mol) 气体摩尔质量=22.4mol/L×标准状况下气体的密度(g/L) ②同温同压下任何气体的体积比等于其分子个数之比.也等于其物质的量之比 ③同温同压下任何气体的密度比等于其相对分子质量之比.也等于同体积的质量之比. ④在温度和体积一定时.气体的压强与物质的量成正比,若温度和压强一定时.气体的体积与物质的量成正比. ⑤在温度与气体的物质的量一定时.其气体的压强与体积成反比. 例6:A容器中盛有体积百分比为80%的H2和20%的O2.试求: (1)混合气体中H2和O2的分子数之比.质量之比各为多少? (2)混合气体的平均分子量是多少?它在标准状况下的密度是多少? (3)在1500C时.引燃混合气体.反应结束后恢复到1500C.则反应后混合气体的平均分子量是多少?引燃前后..A容器内的压强有什么变化?密度是否变化? 解析:(1)分子数之比等于体积比等于物质的量比.所以 H2和O2的分子数之比为:80%:20%=4:1 质量之比为:4×2:1×32=1:4 (2)混合气体的平均分子量M=2×80%+32×20%=8 在标准状态下r=8/22.4=0.357(g/L) (3) 2H2 + O2 = 2 H2O 2mol 1mol 2mol 可见,4molH2和1molO2反应后,得到了2mol H2O和2molH2的混合气体,所以 反应后的平均分子量为:18×2/4+2×2/4=10; 在保持温度和体积不变的条件下,气体的压强之比等于物质的量之比 所以 P前:P后==5:4. 反应后压强变小.根据质量守恒定律.反应前后的质量不变. A容器的体积不变.所以混合气体的密度不变.
网址:http://m.1010jiajiao.com/timu_id_4426363[举报]
乙烯(C2H4)是一种重要的工业原料,在化学工业上有着重要的用途.乙烯完全燃烧时,每一个乙烯分子能和两个B分子反应生成两个C分子和两个D分子,如图所示.
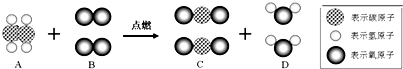
请根据示意图回答下列问题:
(1)上述反应中, (填“分子”、“原子”之一)是化学变化中的最小微粒.
(2)上述反应一定 质量守恒定律(填“遵守”、“不遵守”之一).
(3)上述反应的化学方程式为 .
(4)上述反应属于 反应(填“分解”、“化合”、“置换”、“复分解”、“氧化”之一).
查看习题详情和答案>>

请根据示意图回答下列问题:
(1)上述反应中,
(2)上述反应一定
(3)上述反应的化学方程式为
(4)上述反应属于
(1)下列说法正确的是
A.油脂水解可得到氨基酸和甘油
B.用酸性KMnO4溶液可以鉴别甲烷与乙烯
C.CH4和C5H12一定互为同系物
D.在蛋白质溶液中加入硫酸铜溶液,蛋白质会发生凝聚,加水后又能溶解
(2)某有机物X中碳的质量分数约为83.72%,此有机物蒸气在相同条件下是同体积氢气质量的43倍,若X结构中含有2个甲基,则X的结构简式为
(3)苯可以和浓硫酸发生取代反应生成苯磺酸( ),根据质量守恒定律,可判断出另一个反应产物为
),根据质量守恒定律,可判断出另一个反应产物为
查看习题详情和答案>>
BC
BC
A.油脂水解可得到氨基酸和甘油
B.用酸性KMnO4溶液可以鉴别甲烷与乙烯
C.CH4和C5H12一定互为同系物
D.在蛋白质溶液中加入硫酸铜溶液,蛋白质会发生凝聚,加水后又能溶解
(2)某有机物X中碳的质量分数约为83.72%,此有机物蒸气在相同条件下是同体积氢气质量的43倍,若X结构中含有2个甲基,则X的结构简式为
CH3CH2CH2CH2CH2CH3
CH3CH2CH2CH2CH2CH3
.(3)苯可以和浓硫酸发生取代反应生成苯磺酸(
 ),根据质量守恒定律,可判断出另一个反应产物为
),根据质量守恒定律,可判断出另一个反应产物为H2O
H2O
.(1)2mol O2和3mol O2的质量之比
(2)气体化合物A分子式可表示为OxFy,已知同温同压下10mL A受热分解生成15mL O2和10mL F2,则A的化学式为
查看习题详情和答案>>
2:3
2:3
,分子数之比2:3
2:3
,同温同压的密度之比1:1
1:1
,含氧原子数之比2:3
2:3
,同温同压的体积之比2:3
2:3
.(2)气体化合物A分子式可表示为OxFy,已知同温同压下10mL A受热分解生成15mL O2和10mL F2,则A的化学式为
O3F2
O3F2
,推断的依据为阿伏加德罗定律和质量守恒定律
阿伏加德罗定律和质量守恒定律
.同温同压下,1体积氮气和3体积氢气化合生成2体积氨气,已知氮气和氢气都由简单分子构成,推断他们都是双原子分子和氨的化学式的主要依据是①阿伏加德罗定律 ②质量守恒定律③原子或分子数只能为整数 ④化合价规则( )
查看习题详情和答案>>
(1)质量分数为28%的氢氧化钾溶液中,平均
(2)相同条件下,10mL A2气体与30mL B2气体化合成20mL C气体,则C的化学式为
(3)1.204×1024个CO2分子在标准状况下的体积为
(4)相同质量的二氧化硫和三氧化硫,所含有的分子数之比为
(5)12.4gNa2X中含有Na+0.4mol,则Na2X的摩尔质量为
查看习题详情和答案>>
8
8
个水分子中溶有一个氢氧根离子.(2)相同条件下,10mL A2气体与30mL B2气体化合成20mL C气体,则C的化学式为
AB3或B3A
AB3或B3A
(用A、B的式子表示)得到此结论的依据阿伏伽德罗
阿伏伽德罗
定律和质量守恒
质量守恒
定律(3)1.204×1024个CO2分子在标准状况下的体积为
44.8
44.8
L,5molCO32-是300
300
g,它和480
480
gSO42-含有相同的离子数.(4)相同质量的二氧化硫和三氧化硫,所含有的分子数之比为
3:2
3:2
;所含有的氧原子的物质的量之比为1:1
1:1
.(5)12.4gNa2X中含有Na+0.4mol,则Na2X的摩尔质量为
62g/mol
62g/mol
,X的相对原子质量为16
16
.