��Ŀ����
��ϩ��C2H4����һ����Ҫ�Ĺ�ҵԭ�ϣ��ڻ�ѧ��ҵ��������Ҫ����;����ϩ��ȫȼ��ʱ��ÿһ����ϩ�����ܺ�����B���ӷ�Ӧ��������C���Ӻ�����D���ӣ���ͼ��ʾ��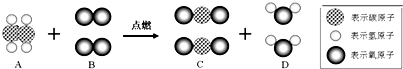
�����ʾ��ͼ�ش��������⣺
��1��������Ӧ�У�
��2��������Ӧһ��
��3��������Ӧ�Ļ�ѧ����ʽΪ
��4��������Ӧ����
���������ݱ仯��ʾ��ͼ�����ӹ���ģ��ͼ�����÷�����ԭ�ӹ��ɵ��ص㣬��ȷ��Ӧǰ����ӵĹ��ɡ����༰�������жϷ�Ӧ�������ֳ��Ĺ��ɣ�
����⣺��1���ɷ�Ӧ��ʾ��ͼ����Ӧǰ��ԭ�ӱ�����û�иı䣬ֻ��ͨ�����½���γ��µķ��ӣ���ˣ�ԭ���ǻ�ѧ�仯����С�����ʴ�Ϊ��ԭ�ӣ�
��2���ɷ�Ӧ��ͼ�з��Ӹ����������ӵĹ��ɣ���Ӧǰ����2��Cԭ�ӡ�4��Hԭ�ӡ�6����ԭ�ӣ�����Ӧ����ȻΪ2��Cԭ�ӡ�4��Hԭ�ӡ�6��Oԭ�ӣ��ɼ���Ӧǰ��ԭ�����ࡢ������û�иı䣬��˷�Ӧ��ѭ�����غ㶨�ɣ��ʴ�Ϊ�����أ�
��3�����ݸ����ʵķ��ӹ��ɣ�����A�ķ���ΪC2H4������B�ķ���ΪO2������C�ķ���ΪCO2������D�ķ���ΪH2O���ʷ�Ӧ�Ļ�ѧ����ʽΪC2H4+2O2
2CO2+2H2O���ʴ�Ϊ��C2H4+2O2
2CO2+2H2O��
��4���÷�Ӧ�Ȳ����ڻ��Ϸ�Ӧ���ֽⷴӦ���û���Ӧ��Ҳ�����ڸ��ֽⷴӦ���÷�Ӧ�����������������ķ�Ӧ��Ϊ������Ӧ���ʴ�Ϊ��������Ӧ��
��2���ɷ�Ӧ��ͼ�з��Ӹ����������ӵĹ��ɣ���Ӧǰ����2��Cԭ�ӡ�4��Hԭ�ӡ�6����ԭ�ӣ�����Ӧ����ȻΪ2��Cԭ�ӡ�4��Hԭ�ӡ�6��Oԭ�ӣ��ɼ���Ӧǰ��ԭ�����ࡢ������û�иı䣬��˷�Ӧ��ѭ�����غ㶨�ɣ��ʴ�Ϊ�����أ�
��3�����ݸ����ʵķ��ӹ��ɣ�����A�ķ���ΪC2H4������B�ķ���ΪO2������C�ķ���ΪCO2������D�ķ���ΪH2O���ʷ�Ӧ�Ļ�ѧ����ʽΪC2H4+2O2
| ��ȼ |
| ��ȼ |
��4���÷�Ӧ�Ȳ����ڻ��Ϸ�Ӧ���ֽⷴӦ���û���Ӧ��Ҳ�����ڸ��ֽⷴӦ���÷�Ӧ�����������������ķ�Ӧ��Ϊ������Ӧ���ʴ�Ϊ��������Ӧ��
���������⿼�黯ѧ����Ҫ�ص������壬ע�����ո��ݱ仯��ʾ��ͼ�����ӹ���ģ��ͼ�����ݷ�����ԭ�ӹ��ɵ��ص㣬��ȷ�жϱ仯�е����ʹ��ɣ��ǽ����Ļ�����������Ŀ�ѶȲ���

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
��14�֣�������ЧӦ���Ǹ籾��������仯����о��Ļ�������֮һ��CO2��Ŀǰ�����к�����ߵ�һ���������塣��ˣ����ƺ�����CO2�ǽ��������ЧӦ������Ч;����
��1�� ����һ��;���ǽ�CO2ת�����л���ʵ��̼ѭ�����磺
2CO2(g)��2H2O(l) ="=" C2H4(g)��3O2(g) ��H��+1411.0 kJ/mol
2CO2(g)��3H2O(l) ="=" C2H5OH(1)��3O2(g) ��H��+1366.8 kJ/mol
������ϩˮ�����Ҵ���Ӧ���Ȼ�ѧ����ʽΪ ��
��2����һ�������£�6H2(g) +2CO2(g) CH3CH2OH(g)+3H2O(g)��
CH3CH2OH(g)+3H2O(g)��
| | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
�� �¶�һ��ʱ�������̼��[n(H2)/n(CO2)]��CO2��ת���� ���������С�������䡱����
�� �÷�Ӧ������ӦΪ ��������š����ȷ�Ӧ��
��3��һ�������£���3molH2��1molCO2�����������ڹ̶��ݻ�Ϊ2L���ܱ������У��������·�Ӧ��3H2��g��+ CO2��g��
 CH3OH��g��+ H2O��g����2minĩ�÷�Ӧ�ﵽƽ�⣬���CH3OH��Ũ��Ϊ0.2mol/L�������жϲ���ȷ���� ��
CH3OH��g��+ H2O��g����2minĩ�÷�Ӧ�ﵽƽ�⣬���CH3OH��Ũ��Ϊ0.2mol/L�������жϲ���ȷ���� ��a. �������´˷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪ
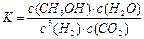
b. H2��ƽ����Ӧ����Ϊ0��3mol/(L��s)
c. CO2��ת����Ϊ60%
d. �����������ܶȲ��ٸı�ʱ���÷�Ӧһ���ﵽƽ��״̬
|
��5��CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ��CaCO3��һ���������ʣ���Ksp=2.8��10��9��CaCl2��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ2��10��4mo1/L �������ɳ�������CaCl2��Һ����СŨ��Ϊ���� ��
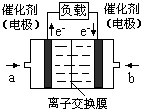 ����������b���缫�Ϸ����ĵ缫��Ӧ�ǣ�
����������b���缫�Ϸ����ĵ缫��Ӧ�ǣ�

