摘要:3.(安徽2008-2009萧城一中第四次月考)Cu(NO3)2受热分解后的产物为不含氮元素的固体.NO2和O2.CuO在一定温度下可发生下列反应:.试回答下列问题: (1)若Cu(NO3)2受热分解后生成的NO2和O2的物质的量之比为4:1.则铜元素的化合价在分解前后是否发生了变化 .其理由是 (2)若称到 Cu(NO3)2强热使其分解得到NO2和O2.还有 固体.将气体用水充分吸收后还有残余气体同时得到100溶液.则该溶液物质的量浓度为 mol.L-1(用含的式子表示). 中=3.76.=1.52.试通过计算求残留固体的成分及其质量. [解析](1)不变.因为Cu(NO3)2分解生成的NO2和O2的物质的量比为4:1.则氮元素得电子数与氧元素失电子数相等.所以反应前后Cu元素的化合价不变. (2)0.106m (或5m/47) ·L-1 (3)3.76的物质的量为.若分解得到的固体产物全部为.则m=.若 分解生成的残渣为.则m= 而现在质量为1.52g.则残渣成分为和的混合物.依题意得: 解之得 . [答案]见解析
网址:http://m.1010jiajiao.com/timu_id_4426330[举报]
(2008?平顶山模拟)t℃时,将2mol SO2和1mol O2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H=-196.6kJ/mol.2min时反应达到化学平衡,此时测得反应物O2 还剩余0.8mol.请填写下列空白:
(1)下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)
A.容器内压强不再发生变化 B.SO2的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化2
(2)从反应开始至达到化学平衡,生成SO3平均反应速率为
(3)反应达到化学平衡后,以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是
A.向容器中通入少量O2 B.向容器中通入少量SO2
C.使用催化剂 D.降低温度
E.向容器中通入少量氦气(已知氦气和SO2、O2、SO3都不发生反应)
(4)上述反应达平衡后,若继续向上述容器中通入1.6mol SO2、0.8mol O2、0.4mol SO3,化学平衡将
(5)t℃时,若将物质的量之比n(SO2):n(O2)=1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到化学平衡时,混合气体体积减少了20%,则SO2的转化率为
查看习题详情和答案>>
(1)下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)
AB
AB
A.容器内压强不再发生变化 B.SO2的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化2
(2)从反应开始至达到化学平衡,生成SO3平均反应速率为
0.1mol.L-1.min-1
0.1mol.L-1.min-1
;平衡时混合气体中SO3的物质的量分数为14.3%
14.3%
.(3)反应达到化学平衡后,以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是
A D
A D
A.向容器中通入少量O2 B.向容器中通入少量SO2
C.使用催化剂 D.降低温度
E.向容器中通入少量氦气(已知氦气和SO2、O2、SO3都不发生反应)
(4)上述反应达平衡后,若继续向上述容器中通入1.6mol SO2、0.8mol O2、0.4mol SO3,化学平衡将
向右
向右
移动(填“向右”、“向左”或“不”),混合气体的平均相对分子质量将增大
增大
(填“增大”、“减小”或“不变”);(5)t℃时,若将物质的量之比n(SO2):n(O2)=1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到化学平衡时,混合气体体积减少了20%,则SO2的转化率为
80%
80%
.(2008?茂名二模)生产着色铝片的工艺流程如下:
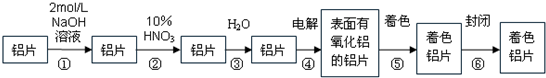
请回答下列问题:
(1)第①步中NaOH溶液的作用是
(2)第②步HNO3的作用是对铝片进行抛光,写出其反应的离子方程式
(3)在第④步电解是以铝为阴极,铝片为阳极,在硫酸介质中控制电压电流,使阳极放出O2与Al反应使铝表面形成一层致密的氧化膜.写出有关的电极反应式:阴极:
(4)氧化膜质量的检验:取出铝片干燥,在氧化膜未经处理的铝片上分别滴一滴氧化膜质量检查液(3gK2CrO4+75mL水+25mL浓盐酸),判断氧化膜质量的依据是
A.铝片表面有无光滑 B.比较颜色变化
C.比较质量大小 D.比较反应速率大小
(5)将已着色的铝干燥后在水蒸气中进行封闭处理约20~30min,封闭的目的是使着色的氧化膜更加致密,有关反应化学方程式是
查看习题详情和答案>>

请回答下列问题:
(1)第①步中NaOH溶液的作用是
洗去铝表面的油污
洗去铝表面的油污
.(2)第②步HNO3的作用是对铝片进行抛光,写出其反应的离子方程式
Al+4H++NO3-=Al3++NO↑+2H2O
Al+4H++NO3-=Al3++NO↑+2H2O
.(3)在第④步电解是以铝为阴极,铝片为阳极,在硫酸介质中控制电压电流,使阳极放出O2与Al反应使铝表面形成一层致密的氧化膜.写出有关的电极反应式:阴极:
6H++6e-=H2↑
6H++6e-=H2↑
,阳极:2Al+3H2O-6e-=Al2O3+6H+
2Al+3H2O-6e-=Al2O3+6H+
.(4)氧化膜质量的检验:取出铝片干燥,在氧化膜未经处理的铝片上分别滴一滴氧化膜质量检查液(3gK2CrO4+75mL水+25mL浓盐酸),判断氧化膜质量的依据是
B
B
.A.铝片表面有无光滑 B.比较颜色变化
C.比较质量大小 D.比较反应速率大小
(5)将已着色的铝干燥后在水蒸气中进行封闭处理约20~30min,封闭的目的是使着色的氧化膜更加致密,有关反应化学方程式是
2Al+3H2O(g)
Al2O3+3H2(g)
| ||
2Al+3H2O(g)
Al2O3+3H2(g)
.
| ||
(2013?浙江模拟)2008年9月,我国爆发了三鹿婴幼儿奶粉受污染事件,导致食用了受污染奶粉的婴幼儿产生肾结石病症,经调查发现三鹿牌婴幼儿配方奶粉中加入了有毒的三聚氰胺(化学式为 C3N3(NH2)3 )牛奶和奶粉都要按规定检测蛋白质的含量,通用的蛋白质测试方法是“凯氏定氮法”,即通过测出含氮量来估算蛋白质含量.牛奶和奶粉添加三聚氰胺,主要是因为它能提高含氮量,冒充蛋白质.
(1)三聚氰胺相对子质量是
(2)各个品牌奶粉中蛋白质含量为15-20%,蛋白质中含氮量平均为16%.以某合格奶粉蛋白质含量为18%计算,含氮量为2.88%.如果三鹿牌奶粉1袋(400g)中加了1g三聚氰铵,相当于蛋白质含量增加了
查看习题详情和答案>>
(1)三聚氰胺相对子质量是
126
126
.其含氮的质量分数为66.7%
66.7%
.(2)各个品牌奶粉中蛋白质含量为15-20%,蛋白质中含氮量平均为16%.以某合格奶粉蛋白质含量为18%计算,含氮量为2.88%.如果三鹿牌奶粉1袋(400g)中加了1g三聚氰铵,相当于蛋白质含量增加了
1
1
%(2008?珠海一模)对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.若25℃时有HA?H++A-,则该弱酸的电离平衡常数的表达式为K=
.下表是几种常见弱酸的电离平衡常数(25℃).
请回答下列各题:
(1)K只与温度有关,当温度升高时,K值
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律是K1:K2:K3≈1:10-5:10-10,产生此规律的原因是:
查看习题详情和答案>>
| C(A-).C(H+) |
| C(HA) |
| C(A-).C(H+) |
| C(HA) |
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COOH-+H+ | 1.76×10-5 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++HCO32- |
K1=4.31×10-7 K2=5.61×10-11 |
| H2S | H2S?H++HS- HS-?H++S2- |
K1=9.1×10-8 K2=1.1×10-12 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-H++HPO42- HPO42-?H++PO43- |
K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
(1)K只与温度有关,当温度升高时,K值
增大
增大
(填“增大”、“减小”或“不变”).(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?
K值越大,电离出的氢离子浓度越大,所以酸性越强
K值越大,电离出的氢离子浓度越大,所以酸性越强
.(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是
H3PO4
H3PO4
,最弱的是HPO42-
HPO42-
.(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数,对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律是K1:K2:K3≈1:10-5:10-10,产生此规律的原因是:
上一级电离产生的H+对下一级电离有抑制作用
上一级电离产生的H+对下一级电离有抑制作用
.(2008?闵行区模拟)一定质量的某硝酸钾样品中不含可溶性杂质,在10℃时加一定量蒸馏水使之充分溶解,残留固体的质量为250g,若升温至40℃,残留固体的质量为120g;升温至70℃,残留固体的质量为20g.已知KNO3在不同温度下的溶解度:
|
查看习题详情和答案>>