网址:http://m.1010jiajiao.com/timu_id_4426310[举报]
(09全国卷Ⅱ28)(15分)已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。

回答下列问题:
(1)A中加入的物质是_____________①_____________________________.
发生反应的化学方程式是_______________②_______________________;
(2)B中加入的物质是_____③________,其作用是_________④_______________:
(3)实验时在C中观察到得现象是_____________⑤_________________,
发生反应的化学方程式是_________________⑥____________________;
(4) 实验时在D中观察到得现象是________________⑦__________________,
D中收集到的物质是_______⑧_______,检验该物质的方法和现象是_________⑨_____________.
查看习题详情和答案>> (09山东卷)某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如右图所示。据图判断正确的是
(09山东卷)某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如右图所示。据图判断正确的是
A.ll为盐酸稀释时的pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点KW的数值比c点KW的数值大
D.b点酸的总浓度大于a点酸的总浓度
查看习题详情和答案>>(8分)(2010·山东卷)利用从冬青中提取的有机物A合成抗结肠炎药物Y及其他化学品,合成路线如下:

提示: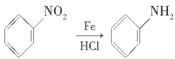
根据上述信息回答:
(1)D不与NaHCO3溶液反应,D中官能团的名称是________,B→C的反应类型是________。
(2)写出A生成B和E的化学反应方程式________。
(3)A的同分异构体I和J是重要的医药中间体,在浓硫酸的作用下I和J分别生成 ,鉴别I和J的试剂为________。
,鉴别I和J的试剂为________。
(4)A的另一种同分异构体K用于合成高分子材料,K可由 制得,写出K在浓硫酸作用下生成的聚合物的结构简式________。
制得,写出K在浓硫酸作用下生成的聚合物的结构简式________。
查看习题详情和答案>>
![]() (09全国卷)用0.10 mol·L-1的盐酸滴定0.10 mol·L-1的氨水,滴定过程中不可能出现的结果是
(09全国卷)用0.10 mol·L-1的盐酸滴定0.10 mol·L-1的氨水,滴定过程中不可能出现的结果是
![]() A.c(NH4+)>c(Cl-),c(OH-)>c(H+)
A.c(NH4+)>c(Cl-),c(OH-)>c(H+)
![]() B.c(NH4+)=c(Cl-),c(OH-)=c(H+)
B.c(NH4+)=c(Cl-),c(OH-)=c(H+)
![]() C.c(Cl-)> c(NH4+), c(OH-)>c(H+)
C.c(Cl-)> c(NH4+), c(OH-)>c(H+)
![]() D.c(Cl-)> c(NH4+),c(H+)> c(OH-)
D.c(Cl-)> c(NH4+),c(H+)> c(OH-)
(8分)(2009·山东卷)运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g) ===2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”);使用催化剂________反应的ΔH(填“增大”“减小”或“不改变”)。
(2)已知:O2(g)===O2+(g)+e-
ΔH1=1175.7 kJ·mol-1①
PtF6(g)+e-===PtF6-(g)
ΔH2=-771.1 kJ·mol-1②
O2+PtF6-(s)===O2+(g)+PtF6-(g)
ΔH3=482.2 kJ·mol-1③
则反应O2(g)+PtF6(g)===O2+PtF6-(s)的ΔH=________kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=________。
查看习题详情和答案>>