网址:http://m.1010jiajiao.com/timu_id_4426298[举报]
![]()
![]()
![]() (09全国卷)
(09全国卷)![]()
![]() 已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
![]()
![]()

![]()
![]()
![]()
![]() 回答下列问题:
回答下列问题:
![]()
![]() (1)A中加入的物质是_______.
(1)A中加入的物质是_______.![]()
![]() 发生反应的化学方程式是____________;
发生反应的化学方程式是____________;
![]()
![]() (2)B中加入的物质是______,其作用是____________:
(2)B中加入的物质是______,其作用是____________:
![]()
![]() (3)实验时在C中观察到得现象是_______________,
(3)实验时在C中观察到得现象是_______________,![]()
![]() 发生反应的化学方程式是______________________;
发生反应的化学方程式是______________________;
![]()
![]() (4) 实验时在D中观察到得现象是___,
(4) 实验时在D中观察到得现象是___,![]()
![]() D中收集到的物质是____,检验该物质的方法和现象是____________.
D中收集到的物质是____,检验该物质的方法和现象是____________.
(06年天津卷)已知反应:①101kPa时,2C(s)+O2(g)=2CO(g);△H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(1);△H=-57.3kJ/mol
下列结论正确的是()
A 碳的燃烧热大于110.5kJ/mol
B ①的反应热为221kJ/mol
C 稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ/mol
D 稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
查看习题详情和答案>>
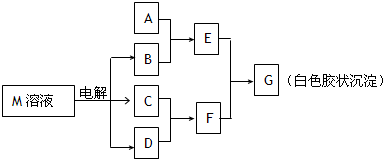
(1)若A是与X、Y同周期的一种常见金属,则A元素在周期表中的位置是
(2)若A是某元素的一种常见酸性氧化物,可用于制造光导纤维,则该元素原子结构示意图为


(3)B的电子式为
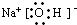
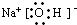


(4)工业上用电解物质M的产物之一氧化有毒含氰(CN-)碱性废水,得到无毒的N2、CO2等.写出此反应的离子反应方程式
(1)组成A分子的原子的核外电子排布式是__________ ;
(2)B和C的分子式分别是_______ 和________ ;C分子的立体结构呈_______ 型,该分子属于______ 分子(填“极性”或“非极性”);
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成。则D的分子式是________ ,该反应的化学方程式为 ______ ;
(4)若将1mol E在氧气中完全燃烧,只生成1mol CO2和2molH2O,则E的分子式是 。
查看习题详情和答案>>