摘要:2.将A与B的混合物15mol放人容积为2L的密闭容器里.在一定条件下发生反应:2A C.经过15min达到平衡.达平衡时容器内的压强是反应前的.则以B气体的浓度变化表示的反应速率是( ) A.0.15mol·L-1·min-1 B.0.3mol·L-1·min-1 C.0.45mol·L-1·min-1 D.0.6mol·L-1·min-1
网址:http://m.1010jiajiao.com/timu_id_4426273[举报]
|
将A与B的混合物15 mol放入容积为2 L的密闭容器里,在一定条件下发生反应2A(g)+3B(g) | |
| [ ] | |
A. |
0.15 mol·L-1·min-1 |
B. |
0.3 mol·L-1·min-1 |
C. |
0.45 mol·L-1·min-1 |
D. |
0.6 mol·L-1·min-1 |
|
将16 g FeS与FeO的混合物,投入到1 L 1 mol/L的硝酸溶液中充分反应,只产生1/3 mol NO气体,得到澄清的混合溶液.下列计算结果正确的是 | |
A. |
混合物中含有0.5 mol FeS |
B. |
混合物中含有0.1 mol FeO |
C. |
参加反应的HNO3为1 mol |
D. |
氧化产物Fe3+为0.15 mol |
|
将16 g FeS与FeO的混合物,投入到含有1 mol的硝酸溶液中充分反应,只产生1/3 mol NO气体,得到澄清的混合溶液.下列计算结果正确的是 | |
| [ ] | |
A. |
混合物中含有0.5 mol FeS |
B. |
混合物中含有0.1 mol FeO |
C. |
参加反应的HNO3为1 mol |
D. |
氧化产物Fe3+为0.15 mol |
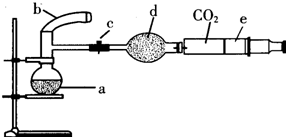 图中,a是250mL的烧瓶,其中盛有标准状况下的空气(O2占
图中,a是250mL的烧瓶,其中盛有标准状况下的空气(O2占| 1 | 5 |
(1)将气球b中的Cu粉小心倒入烧瓶中,要使Cu粉发生反应,是否一定需要对反应混合物进行加热
(2)欲加快铜与硝酸反应速率,可采用多种不同的措施,若采用化学试剂法,下列试剂中可以使用的是(填代号)
A.蒸馏水 B.无水醋酸钠 C.石墨 D.AgNO3溶液(少量)
(3)将烧瓶不断振荡,发现气球逐渐变小,直至被吸入烧瓶内,发生这一现象的原因是(用化学方程式表示)
(4)打开弹簧夹将CO2推入干燥管内继续振荡,使气体与气体,气体与液体间充分接触,可使剩余铜粉完全溶解,上述过程中干燥管内发生反应的化学方程式为
(2011?武胜县一模)现有短周期元素组成的A、B、C、D、E五种物质,存在如下转化关系(部分产物已略去),其中E为黑色粉末,D为无色气体.

(1)若B为含氯元素的钾盐,与浓盐酸反应可以生成黄绿色气体,且1mol B转移5mol 电子,则B与浓盐酸反应的化学方程式为
(2)将F从混合物中分离出来的实验操作步骤为
(3)电解F的饱和水溶液得到碱溶液M,写出该反应的离子方程式;
(4)固体C与FeCl3溶液按物质的量为2:1反应的离子方程式
将Fe(OH)3和NaOH与NaClO混合作用后,是制得緑色水处理剂(Na2FeO4)的一种方法,请完成下列方程式:
查看习题详情和答案>>

(1)若B为含氯元素的钾盐,与浓盐酸反应可以生成黄绿色气体,且1mol B转移5mol 电子,则B与浓盐酸反应的化学方程式为
KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
. 生成的氧化产物与还原产物的物质的量之比为5:1
5:1
;(2)将F从混合物中分离出来的实验操作步骤为
溶解
溶解
、过滤
过滤
、蒸发
蒸发
.由A制得2mol D时,转移电子数为4
4
mol(3)电解F的饱和水溶液得到碱溶液M,写出该反应的离子方程式;
2Cl-+2H2O
H2↑+Cl2↑+2OH-
| ||
2Cl-+2H2O
H2↑+Cl2↑+2OH-
,若将浓度为 c mol?L-1 的M溶液与0.2mol?L-1 的一元酸HA等体积混合,所得溶液pH=7.溶液中离子浓度的大小关系为
| ||
c(K+)=c(A-)>c(OH-)=c(H+)
c(K+)=c(A-)>c(OH-)=c(H+)
(浓度用C表示).(4)固体C与FeCl3溶液按物质的量为2:1反应的离子方程式
2Na2O2+Fe3++2H2O=Fe(OH)3↓+4Na++O2↑+OH-
2Na2O2+Fe3++2H2O=Fe(OH)3↓+4Na++O2↑+OH-
;将Fe(OH)3和NaOH与NaClO混合作用后,是制得緑色水处理剂(Na2FeO4)的一种方法,请完成下列方程式:
2
2
Fe(OH)3+4
4
NaOH+3
3
NaClO=2
2
Na2FeO4+3
3
NaCl+5
5
H2O.