摘要:向饱和的亚硫酸钠溶液中通入过量的氯气.生成的钠盐可能有( ) A.1种 B.2种 C.3种 D.4种
网址:http://m.1010jiajiao.com/timu_id_4424396[举报]
硫代硫酸钠(Na2S2O3,在酸性溶液中不能稳定存在)可由亚硫酸钠和硫粉通过化合反应制得,装置如图Ⅰ;有关物质的溶解度曲线如图Ⅱ所示.
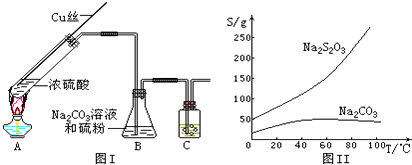
(1)Na2S2O3?5H2O的制备:
①写出试管内发生反应的化学方程式: .
②B中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.当B中溶液的pH接近7时就停止加热,理由是 ;装置C的作用是 .
③过滤B中的混合液,将滤液经过 、 、过滤、洗涤、烘干,得到产品.
(2)饱和Na2CO3溶液吸收少量SO2后所得溶液呈弱碱性,含有OH-、SO32-、HCO3-等阴离子.
请设计试验方案,证明“滤液”中存在SO32-、HCO3-,在答题卡上写出实验步骤、预期现象和结论.
限选仪器及试剂:pH计、小烧杯、试管、带塞导气管、滴管、玻璃棒、过滤装置和滤纸;2mol/L盐酸、1mol/LBaCl2溶液、1 mol/LBa(NO3)2溶液、品红溶液、紫色石蕊试液、澄清石灰水等.
查看习题详情和答案>>

(1)Na2S2O3?5H2O的制备:
①写出试管内发生反应的化学方程式:
②B中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.当B中溶液的pH接近7时就停止加热,理由是
③过滤B中的混合液,将滤液经过
(2)饱和Na2CO3溶液吸收少量SO2后所得溶液呈弱碱性,含有OH-、SO32-、HCO3-等阴离子.
请设计试验方案,证明“滤液”中存在SO32-、HCO3-,在答题卡上写出实验步骤、预期现象和结论.
限选仪器及试剂:pH计、小烧杯、试管、带塞导气管、滴管、玻璃棒、过滤装置和滤纸;2mol/L盐酸、1mol/LBaCl2溶液、1 mol/LBa(NO3)2溶液、品红溶液、紫色石蕊试液、澄清石灰水等.
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“滤液”于小烧杯中,用滴管向小烧杯加入过量l mol/L BaCl2溶液. | 若出现白色浑浊,溶液可能存在SO32-. |
| 步骤2:将小烧杯中的浊液过滤、洗涤,将所得固体、滤液分别置于试管A、B备用. | / |
| 步骤3:向试管A中加入 |
|
| 步骤4:向试管B中加入 |
下列离子方程式书写正确的是
- A.向饱和NaHCO3溶液中通入过量SO2:SO2+HCO3-═CO2↑+HSO3-
- B.亚硫酸氢铵溶液和足量氢氧化钠溶液的反应:NH4++OH-═NH3?H2O
- C.澄清石灰水与少量Ca(HCO3)2溶液混合:Ca2++2OH-+2 HCO3-═CaCO3↓+CO32-+2H2O
- D.NH4Al(SO4)2溶液中加入过量Ba(OH)2溶液:2Al3++2SO42-+2Ba2++8OH-═2[Al(OH)4]-+2BaSO4↓
下列离子方程式书写正确的是
- A.向饱和NaHCO3溶液中通入过量SO2:SO2+HCO
 =CO2↑+HSO
=CO2↑+HSO
- B.含等物质的量溶质的亚硫酸氢铵溶液和氢氧化钠溶液的反应:NH
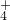 +OH-=NH3?H2O
+OH-=NH3?H2O - C.澄清石灰水与少量Ca(HCO3)2溶液混合:Ca2++2OH-+2HCO
 =CaCO3↓+CO
=CaCO3↓+CO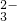 +2H2O
+2H2O - D.NH4Al(SO4)2溶液中加入过量Ba(OH)2溶液:Al3++2SO
 +2Ba2++4OH-=AlO
+2Ba2++4OH-=AlO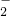 +2BaSO4↓+2H2O
+2BaSO4↓+2H2O