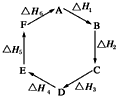
摘要:盖斯定律:化学反应的反应热只与反应的始态和终态有关.而与具体反应进行的途径无关.这就是盖斯定律.利用盖斯定律可以间接计算反应热. 例如:C(s)+O2(g)=CO2(g),△H1 C(s)+O2,△H2 CO(g)+O2(g)=CO2(g),△H3 依盖斯定律有:△H1=△H2+△H3. 第1课时 化学反应的焓变
网址:http://m.1010jiajiao.com/timu_id_4422788[举报]
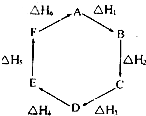 盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关.物质A在一定条件下可发生一系列转化,如图判断下列关系正确的是( )
盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关.物质A在一定条件下可发生一系列转化,如图判断下列关系正确的是( )| A、A→F,△H=-△H 6 | B、△H1+△H 2+△H 3+△H 4+△H 5+△H 6=1 | C、C→F,△H=△H 1+△H 2+△H 6 | D、△H 1+△H 2+△H 3═△H 4+△H5+△H 6 |
盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关.物质A在一定条件下可发生一系列转化,由图判断下列关系错误的是( )
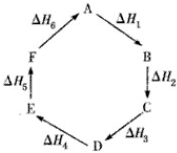

| A、C→F,|△H|=|△H1+△H2+△H6| | B、△H1+△H2+△H3+△H4+△H5+△H6=0 | C、A→F,△H=△H6 | D、|△H1+△H2+△H3|=|△H4+△H5+△H6| |
 盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。物质A在一定条件下可发生一系列转化,由右图判断下列关系错误的是
盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。物质A在一定条件下可发生一系列转化,由右图判断下列关系错误的是
A、A→F,△H=—△H 6
B、△H1+△H 2+△H 3+△H 4+△H 5+△H 6=1
![]()
![]() C、C→F,△H = △H 1+△H 2+△H 6
C、C→F,△H = △H 1+△H 2+△H 6
![]()
![]() D、△H 1+△H 2+△H 3 == △H 4+△H5+△H 6
D、△H 1+△H 2+△H 3 == △H 4+△H5+△H 6