摘要:21.如图是乙醇跟金属钠起反应时放出H2的实验装置.请根据要求填空: (1)在烧瓶中发生反应的化学方程式是: . (2)导管a的作用是:① ,② .导管b的作用是: . (3)若测得有1.15 g C2H6O参加反应.把量筒c中以及导管b中的水的体积换算成标准状况下H2的体积为280 mL.试结合计算和讨论.判断下面两式中.哪个正确.并说明理由 . [解析]该题是课本实验的改进和创新.从定性和定量角度考查了钠与乙醇的反应情况.并验证了乙醇的结构.由(3)可知0.025 mol乙醇产生0.012 5 m01氢气.说明分子中含1个-OH.故(Ⅱ)式正确.[参考答案](1)2Na+2CH3CH2OH → 2C2H5ONa+H2↑ (2)导气 冷凝回流 导出水式正确.因为2mol乙醇产生1molH2 Ⅲ.实验室制乙烯
网址:http://m.1010jiajiao.com/timu_id_4422461[举报]
为了测定乙醇分子中有几个可被置换的氢原子,即确定乙醇的分子结构,可使乙醇跟金属钠反应,使生成的H2排出水,测量排出水的体积可计算出标准状况下H2的体积,根据所消耗乙醇的物质的量,可确定乙醇分子中能被置换的氢原子个数,从而确定乙醇的分子结构 。
(1)若用下列仪器和导管(如下图所示)组装实验装置,如果所制气体流向从左到右时,则仪器与导管连接的顺序(填编号)是( )接( )接( )接( )接( )接( )。
(2)仪器连接好后进行实验时有下列操作:①在仪器F中注入适量的无水乙醇,在C中装入3克碎块状金属钠(足量),在E中注入过量的蒸馏水;②检查气密性;③待仪器C恢复到室温时,测定仪器D中水的体积;④慢慢开启仪器F的活塞,使乙醇逐滴滴下至不再发生反应时关闭活塞。正确的操作顺序是_____________(填序号)。
(3)若实验时消耗2.9 mL 的无水乙醇(密度为0.8 g·mL-1),测量排出的水的体积后折算成标准状况下的H2,体积为560 mL,根据以上数据推算出乙醇分子中可被置换的氢原子个数为_____________,结构式为_____________。
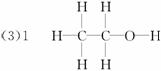
乙醇与甲醚互为同分异构体,下列事实中能说明二者结构不相同的是( )
A.乙醇溶于水,甲醚不溶于水
B.把1份乙醇加入6份浓H2SO4中,当加热到
C.乙醇跟金属钠反应可放出氢气,甲醚不能
D.甲醚比乙醇更易溶于油脂类物质中
查看习题详情和答案>>乙醇可以发生下列化学反应,在反应里乙醇分子中断裂C-O键而失去羟基的是
[ ]
A.乙醇在浓 作用下发生消去反应
作用下发生消去反应
B.乙醇跟金属钠反应
C.乙醇跟氢卤酸反应
D.乙醇在Ag催化下跟 反应
反应
乙醇可以发生下列化学反应,在反应里乙醇分子中断裂C-O键而失去羟基的是
[ ]
A.乙醇在浓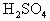 作用下发生消去反应
作用下发生消去反应
B.乙醇跟金属钠反应
C.乙醇跟氢卤酸反应
D.乙醇在Ag催化下跟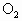 反应
反应
(2011?开封一模)“温室效应”是哥本哈根气候变化大会研究的环境问题之一.CO2是目前大气中含量最高的一种温室气体.因此,控制和治理CO2是解决“温室效应”的有效途径.
(1)其中一种途径是将CO2转化成有机物实现碳循环.如:
2CO2(g)+2H2O(l)═C2H4(g)+3O2(g)△H=+1411.0kJ/mol
2CO2(g)+3H2O(l)═C2H5OH(l)+3O2(g)△H=+1366.8kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为
温度(K)
(2)在一定条件下,6H2(g)+2CO2(g)?CH3CH2OH(g)+3H2O(g).
根据上表中数据分析:
①温度一定时,提高氢碳比[n(H2)/n(CO2)],CO2的转化率
②该反应的正反应为
(3)一定条件下,将3molH2和1molCO2两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3H2(g)+CO2(g)?CH3OH(g)+H2O(g).2min末该反应达到平衡,测得CH3OH的浓度为0.2mol/L.下列判断不正确的是
a.该条件下此反应的化学平衡常数表达式为K=
b.H2的平均反应速率为0.3mol/(L?s)
c.CO2的转化率为60%
d.若混合气体的密度不再改变时,该反应一定达到平衡状态
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是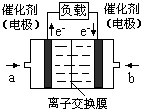 氧气”),b处电极上发生的电极反应是:
氧气”),b处电极上发生的电极反应是:
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为大于
查看习题详情和答案>>
(1)其中一种途径是将CO2转化成有机物实现碳循环.如:
2CO2(g)+2H2O(l)═C2H4(g)+3O2(g)△H=+1411.0kJ/mol
2CO2(g)+3H2O(l)═C2H5OH(l)+3O2(g)△H=+1366.8kJ/mol
则由乙烯水化制乙醇反应的热化学方程式为
C2H4(g)+H2O(l)═C2H5OH(l)△H=-44.2kJ/mol
C2H4(g)+H2O(l)═C2H5OH(l)△H=-44.2kJ/mol
.温度(K)
(2)在一定条件下,6H2(g)+2CO2(g)?CH3CH2OH(g)+3H2O(g).
| CO2转化率(%) n(H2)/n(CO2) |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
①温度一定时,提高氢碳比[n(H2)/n(CO2)],CO2的转化率
增大
增大
(填“增大”“减小”“不变”).②该反应的正反应为
放
放
(填“吸”或“放”)热反应.(3)一定条件下,将3molH2和1molCO2两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3H2(g)+CO2(g)?CH3OH(g)+H2O(g).2min末该反应达到平衡,测得CH3OH的浓度为0.2mol/L.下列判断不正确的是
bcd
bcd
.a.该条件下此反应的化学平衡常数表达式为K=
| c(CH3OH)?c(H2O) |
| c3(H2)?c(CO2) |
c.CO2的转化率为60%
d.若混合气体的密度不再改变时,该反应一定达到平衡状态
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是
乙醇
乙醇
(填“乙醇”或“ 氧气”),b处电极上发生的电极反应是:
氧气”),b处电极上发生的电极反应是:O2+4e-+2H2O=4OH-
O2+4e-+2H2O=4OH-
.(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为大于
2.8×10-5mol/L
2.8×10-5mol/L
.