网址:http://m.1010jiajiao.com/timu_id_4421355[举报]
①每一电子层最多可容纳的电子数为n2(n为电子层数);②最外层电子数最多不超过4个;③次外层电子数最多不超过9个;④电子层数等于周期序数,族序数等于最外层电子数等。则:
(1)K层(第一层)作为最外层时,其电子数不能超过________个。
(2)原子序数为42的元素的原子结构示意图为________。
(3)按这种假设而设计出的元素周期表中(不分主、副等族,统称纵行为族),该元素将位于第________周期,第________族。
(4)该元素原子在化学反应中显示的化合价可能是________,理由是________。
查看习题详情和答案>>
①每一电子层最多可容纳的电子数为n2(n为电子层数);
②最外层电子数最多不超过4个;
③次外层电子数最多不超过9个;
④电子层数等于周期序数,族序数等于最外层电子数等。
则:
(1)K层(第一层)作为最外层时,其电子数不能超过________个。
(2)原子序数为42的元素的原子结构示意图为________。
(3)按这种假设而设计出的元素周期表中(不分主、副等族,统称纵行为族),该元素将位于第________周期,第________族。
(4)该元素原子在化学反应中显示的化合价可能是________,理由是________。
查看习题详情和答案>>
某同学对原子核外电子排布的规律做了如下的假定:
①每一电子层最多可容纳的电子数为n2(n为电子层数);②最外层电子数最多不超过4个;③次外层电子数最多不超过9个;④电子层数等于周期序数,族序数等于最外层电子数等。则:
(1)K层(第一层)作为最外层时,其电子数不能超过________个。
(2)原子序数为42的元素的原子结构示意图为________。
(3)按这种假设而设计出的元素周期表中(不分主、副等族,统称纵行为族),该元素将位于第________周期,第________族。
(4)该元素原子在化学反应中显示的化合价可能是________,理由是________。
查看习题详情和答案>>
(1)水分子中氧原子在基态时核外电子排布式为
(2)H2O分子中氧原子采取的是
(3)水分子容易得到一个H+形成水合氢离子(H3O+).对上述过程的下列描述不合理的是
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.水分子仍保留它的化学性质 D.微粒中的键角发生了改变
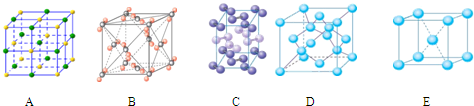
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序).与冰的晶体
类型相同的是
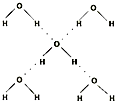
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51kJ/mol,除氢键外,水分子间还存在范德华力(11kJ/mol),则冰晶体中氢键的“键能”是
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子.请写出生成此配合离子的离子方程式:
(7)已知下列元素的电负性数据:H:2.1,O:3.5,F:4.0.OF2与水的立体结构相似,但水分子的极性比OF2强得多,其原因有:①OF2中氧原子上有两对孤对电子,抵消了F一O键中共用电子对偏向F而产生的极性;②从电负性上看,
(8)分析下表数据,请写出你的最具概括性的结论:
| 键型 | 键能 (kJ/mol) |
键长 (pm) |
分子 | 键角 | 物质 | 熔点(℃) | 沸点(℃) |
| H-C | 413 | 109 | 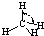 |
109.5° | 甲烷 | -183.7 | -128.0 |
| H-N | 391 | 101 | 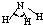 |
107° | 氨 | -77.7 | -33.3 |
| H-O | 467 | 96 | 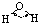 |
104.5° | 水 | 0.0 | 100.0 |
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.乙炔是有机合成工业的一种原料。工业上曾用![]() 与水反应生成乙炔。
与水反应生成乙炔。
(1) ![]() 中
中![]() 与
与![]() 互为等电子体,
互为等电子体,![]() 的电子式可表示为 ;1mol
的电子式可表示为 ;1mol ![]() 中含有的
中含有的![]() 键数目为 。
键数目为 。
(2)将乙炔通入 溶液生成
溶液生成 红棕色沉淀。
红棕色沉淀。 基态核外电子排布式为 。
基态核外电子排布式为 。
 (3)乙炔与氢氰酸反应可得丙烯腈
(3)乙炔与氢氰酸反应可得丙烯腈![]() 。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。
。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。
(4) ![]() 晶体的晶胞结构与
晶体的晶胞结构与![]() 晶体的相似(如右图所示),但
晶体的相似(如右图所示),但![]() 晶体中含有的中哑铃形
晶体中含有的中哑铃形![]() 的存在,使晶胞沿一个方向拉长。
的存在,使晶胞沿一个方向拉长。![]() 晶体中1个
晶体中1个![]() 周围距离最近的
周围距离最近的![]() 数目为 。
数目为 。
B.对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。

一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在![]() 溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(l)上述实验中过滤的目的是 。
(2) 滤液在分液漏斗中洗涤静置后,有机层处于 层(填“上”或'下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有 。
(3) 下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
| 催化剂 | n(催化剂) | 硝化产物中各种异构体质量分数(%) | 总产率(%) | ||
| n(甲苯) | 对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | ||
| 浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 98.0 |
| 1.2 | 36.5 | 59.5 | 4.0 | 99.8 | |
| NaHSO4 | 0.15 | 44.6 | 55.1 | 0.3 | 98.9 |
| 0.25 | 46.3 | 52.8 | 0.9 | 99.9 | |
| 0.32 | 47.9 | 51.8 | 0.3 | 99.9 | |
| 0.36 | 45.2 | 54.2 | 0.6 | 99.9 |
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为 。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是 。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有_ 、 。
查看习题详情和答案>>