网址:http://m.1010jiajiao.com/timu_id_441926[举报]
A.《物质结构与性质》
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于__________晶体;基态Ni原子的电子排布式为__________。
(2)配合物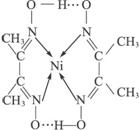 分子内的作用力有____________(填编号)。
分子内的作用力有____________(填编号)。
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH≡CH、③![]() 、④HCHO等,其中碳原子采取sp2杂化的分子有______________(填物质序号),预测HCHO分子的立体结构为___________形。
、④HCHO等,其中碳原子采取sp2杂化的分子有______________(填物质序号),预测HCHO分子的立体结构为___________形。
(4)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如下图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上。该晶体的化学式为____________。

B.《实验化学》
乙醛与银氨溶液的反应常因条件控制不当,会出现黑色浊液、长时间没有银析出、析出的银镜不均匀或发暗等现象,影响了银镜反应的效果。
某研究小组为探究乙醛发生银镜反应的最佳实验条件,进行了有关实验,相关数据如下表:
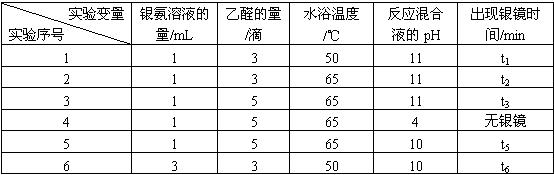 请回答下列问题:
请回答下列问题:
(1)写出乙醛与银氨溶液发生银镜反应的化学方程式:_______________________________。
(2)若只进行实验1和实验2,其探究的目的是_____________。
(3)实验__________(填序号)组合,可探究混合液pH对银镜反应的影响。
(4)实验4无银镜出现的原因是_____________________________________________。
(5)试管内壁的银镜用硝酸洗涤,可以回收硝酸银溶液。你认为选用____________(填“浓硝酸”或“稀硝酸”)较好,理由是___________________________________________________。
查看习题详情和答案>>
(共5分)
环境中的二氧化碳气体可与水形成酸,或同岩石中的碱性物质发生反应,水体中的二氧化碳也可通过沉淀反应变为沉积物从水体中失去,在水与生物体之间的生物化学交换中,二氧化碳占有独特地位,在调节天然水体的pH及其组成方面起着非常重要的作用。在碳酸―天然水平衡体系中,部分生物学家认为碱度可以近似地表征水体的肥力,总碱度通常定义为:c(总碱度)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+)。现有一水体与CaCO3(s)相接触并达到平衡,请判断添加少量下列物质对溶液中钙离子浓度与总碱度的影响(忽略离子强度的影响)[填“增加”、“减少”或“不变”]。
添加物质 | KOH | KCl | Ca(NO3)2 | Na2CO3 | CO2 |
c(Ca2+) |
|
|
|
|
|
c(总碱度) |
|
|
|
|
|
(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意如图1所示。

图1
①X分子的空间结构为 ;
②图1中条件选定的主要原因是(选填字母序号) ;
A.温度、压强对化学平衡影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
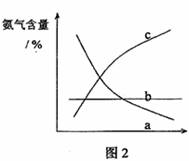
③改变反应条件,会使平衡发生移动。如图2表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母序号) ,当横坐标为温度时,变化趋势正确的是(选填字母序号) 。
(2)常温下氨气极易溶于水,其水溶液可以导电。
①用方程式表示氨气溶于水的过程中存在的可逆反应
;
②常温时,氨水中由水电离出的c(H+)?c(OH―) 10―14(填写“>”、“<”或“=”);
(3)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A和B。A为铵盐,B在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96L氨气(标准状况),同时生成0.3mol A。
①写出氨气和氟气反应的化学方程式 ;
②在标准状况下,每生成1mol B,转移电子的物质的量为 mol。
查看习题详情和答案>> 2SO3 (g) ;△H = -98.3 kJ/mol。将1 mol SO2和0.5 mol O2充入一密闭容器中反应,放出49.15 kJ 的热量
2SO3 (g) ;△H = -98.3 kJ/mol。将1 mol SO2和0.5 mol O2充入一密闭容器中反应,放出49.15 kJ 的热量  C.已知:2SO2 (g) + O2
(g) 2SO3 (g) ;△H = -98.3
kJ/mol。将1 mol SO2和0.5 mol O2充入一密闭容器中反应,放出49.15 kJ 的热量
C.已知:2SO2 (g) + O2
(g) 2SO3 (g) ;△H = -98.3
kJ/mol。将1 mol SO2和0.5 mol O2充入一密闭容器中反应,放出49.15 kJ 的热量