题目内容
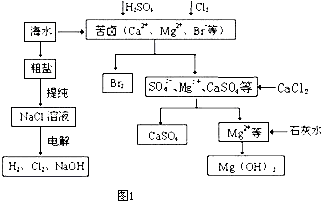
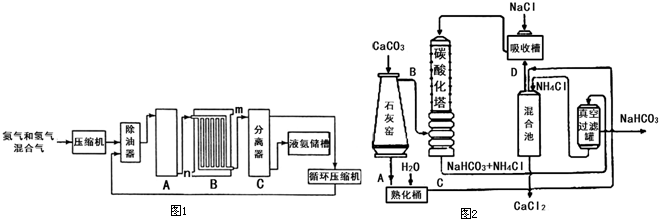
(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意如图1所示。

图1
①X分子的空间结构为 ;
②图1中条件选定的主要原因是(选填字母序号) ;
A.温度、压强对化学平衡影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
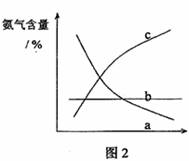
③改变反应条件,会使平衡发生移动。如图2表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母序号) ,当横坐标为温度时,变化趋势正确的是(选填字母序号) 。
(2)常温下氨气极易溶于水,其水溶液可以导电。
①用方程式表示氨气溶于水的过程中存在的可逆反应
;
②常温时,氨水中由水电离出的c(H+)?c(OH―) 10―14(填写“>”、“<”或“=”);
(3)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A和B。A为铵盐,B在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96L氨气(标准状况),同时生成0.3mol A。
①写出氨气和氟气反应的化学方程式 ;
②在标准状况下,每生成1mol B,转移电子的物质的量为 mol。
(1)①三角锥形(1分) ②BC
③c;a
(2)①NH3+H2O![]() NH3?H2O
NH3?H2O![]() NH4++OH― ②<
NH4++OH― ②<
(3)①4NH3+3F2![]() NF3+3NH4F(催化剂要注明) ②6
NF3+3NH4F(催化剂要注明) ②6

 名校课堂系列答案
名校课堂系列答案(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.用于合成氨的工业煤气中含有H2S、C2H5SH(乙酸醇)、COS(羰基硫)、CS2等含硫化合物,工业上无机硫常用氧化锌法处理,有机硫可用钴钼催化加氢处理。
H2S+ZnO=ZnS+H2O;C2H5SH+ZnO=ZnS+C2H4+H2O
C2H5SH+H2=C2H6+H2S;COS+H2=CO+H2S;CS2+4H2=CH4+2H2S
(1)钴原子在基态时核外电子排布式为 。
(2)下列有关分子结构的说法正确的是 。
A.C2H4分子中有5个 键处1个
键处1个 键
键
B.COS分子(结构如右图)中键能C=O>C=S
C.H2S分子呈V形结构
D.CH4、C2H6分子中碳原子均采用sp3杂化
(3)下列有关说法不正确的是 。
A.H2O、CO、COS均是极性分子
B.相同压强下沸点:Cs2>COS >CO2
>CO2
C.相同压强下沸点:C2H 5SH>C2H5OH
5SH>C2H5OH
D.相同压强下沸点:CO>N2
(4) -ZnS的晶胞结构如右图,晶胞中S2-数目为: 个。
-ZnS的晶胞结构如右图,晶胞中S2-数目为: 个。
(5)具有相似晶胞结构的ZnS和ZnO,ZnS熔点为1830℃,ZnO熔点为1975℃,后者较前者高是由于 。
(6)钼的一种配合物化学式为:Na3[Mo(CN)8]·8H2O,中心原子的配位数为 。
B.烃醛结合反应有机合成中颇为重要,绿色催化剂的固体铌酸酸倍受研究者关注。铌酸具有较高的催化活性及稳定性。反应原理如下:
实验方法是在25mL烧瓶中加入铌酸、10mL甲醇和 0.5mL苯甲醛,在回流状态下反应2h,反应的产率和转化率均非常高。
(1)采用回流反应2h的目的是 。
(2)在反应中甲醇需过量,其原因是 。 (3)不同铌酸用量对产率和转化率影响,如下表:
(3)不同铌酸用量对产率和转化率影响,如下表:
| 铌酸用量/mol | 0.01 | 0.02 | 0.03 | 0.05 | 0.1 | 0.15 | 0.2 | 0.6 |
| 产率% | 87.3 | 88.2 | 90.3 | 94.2 | 92.9 | 93.1 | 91.8 | 92.3 |
| 转化率% | 89.7 | 92.1 | 93.9 | 98.9 | 94.9 | 95.7 | 93.9 | 94.3 |
(4)催化剂的回收利用性能是考察催化剂的一项极为重要的指标。铌酸催化剂循环使用次数对产率的影响如右下图,这说明铌酸催化剂的优点之一是 。
(5)用铌酸作催化剂时,不同的醛与甲醇的缩合反应的转化率和产率如下表:
| 序号 | 醛 | 醇 | 转化率% | 产率% |
| 1 | 邻羟基苯甲醛 | 甲醇 | 94.3 | 89.6 |
| 2 | 邻羟基苯甲醛 | 甲醇 | 93.6 | 88.7 |
| 3 | 邻氯苯甲醛 | 甲醇 | 93.1 | 87.3 |
| 4 | 间硝基苯甲醛 | 甲醇 | 54.2 | 34.1 |
| 5 | 邻硝基苯甲醛 | 甲醇 | 89.9 | 79.5 |
| 6 | 对硝基苯甲醛 | 甲醇 | 65.7 | 41.9 |

从表中得出的不同的醛与甲醇缩合反应影响转化率和产率的规律是 。


 (1)合成氨工业对化学工业和国防工业具有重要意义。
(1)合成氨工业对化学工业和国防工业具有重要意义。