摘要:3.情感和价值观目标 通过本实验提高学习化学的兴趣. [实验内容和实验要点] 本学生共包含喷泉实验.实验室制取氨气和铵离子检验三项.实验中应巩固的知识.实验所涉及的实验技能.实验注意事项等列表如下: 实验 内容 应巩固的知识 涉及的实验技能 注意事项 氨 的 制 取 实验室制氨的原理 (1)在试管里加热固体混合物的方法 (2)密度比空气小.又易溶于水的气体的收集方法 (1)装置应不漏气 (2)氯化铵和消石灰工混合均匀 (3)装反应混合物的试管管口要稍向下倾斜.先使试管均匀受热后.再将火焰固定在盛放固体的部位加热 (4)只能用排空气集气法收集氨气.收集氨气的试管要干燥.试管口要用一小团棉花堵住 氨 的 性 质 (1)物理性质(颜色.状态.气味.溶解性) (2)化学性质 (1)闻气味方法 (2)气体的溶解性实验方法 (3)使用浓盐酸.浓硫酸.浓硝酸的技能 (1)在氨的溶解性实验中.试管里就充满氨 (2)氨与酸反应时.三滴不同酸的位置还宜靠得太近 铵离子的检验 铵离子的检验原理 (1)检验铵离子的性质 检验氨气时.不要把石蕊试纸碰到试管口或试管内壁.以免跟反应物中的碱相接触 教师在学生做实验前.应把以上各要点向学生交待清楚.使学生有所准备. 实验过程要求学生观察实验现象.记录实验现象.最后完成实验报告. 教师可补充下列实验内容: A.用浓氨水.氧化钙制氨气, 操作方案:利用实验制氯气的实验装置.在烧中加入氧化钙.分液漏斗中加入浓氨水.逐滴往氧化钙中加入浓氨水.可根据加入浓氨水的速度控制放出氨气的速度. B.浓氨水跟浓盐酸反应产生浓烟现象 操作方案:在一个干燥的大烧杯中.分别把一块蘸有浓氨水.一块蘸有浓盐酸的棉花分开放入大烧杯里.可看到烧杯中有大量白烟产生.此时可提示学生观察白烟主要是在蘸有浓盐酸的棉球上方产生还是在蘸有浓氨水的棉球上方?并让学生分析原因.
网址:http://m.1010jiajiao.com/timu_id_4416570[举报]
二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料.以CH4和H2O为原料制备二甲醚和甲醇的工业流程如图1: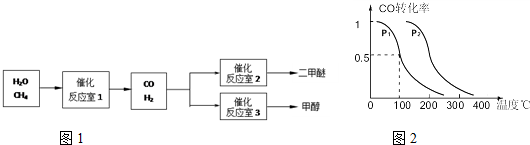
请填空:
(1)在一定条件下,反应室1中发生反应:
CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0.
在其它条件不变的情况下降低温度,逆反应速率将
(2)在压强为0.1MPa条件下,反应室3(容积为2L)中0.2molCO与0.4molH2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g),CO的平衡转化率与温度、压强的关系如图二所示,则:
①P1
②在P1压强下,100℃时,反应CO(g)+2H2(g)?CH3OH(g)的平衡常数K的值为
③在其它条件不变的情况下,反应室3再增加0.2molCO与0.4molH2,达到新平衡时,CO的转化率
查看习题详情和答案>>

请填空:
(1)在一定条件下,反应室1中发生反应:
CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0.
在其它条件不变的情况下降低温度,逆反应速率将
减小
减小
(填“增大”、“减小”或“不变”).将1.0molCH4和2.0molH2O通入反应室1(假设容积为10L),1min末有0.1molCO生成,则1min内反应的平均速率v(H2)=0.03
0.03
mol?L-1?min-1.(2)在压强为0.1MPa条件下,反应室3(容积为2L)中0.2molCO与0.4molH2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g),CO的平衡转化率与温度、压强的关系如图二所示,则:
①P1
<
<
P2 (填“<”、“>”或“=”).②在P1压强下,100℃时,反应CO(g)+2H2(g)?CH3OH(g)的平衡常数K的值为
100
100
若温度不变,再加入1.0molCO后重新达到平衡,则CO的转化率减小
减小
(填“增大”、“不变”或“减小”)③在其它条件不变的情况下,反应室3再增加0.2molCO与0.4molH2,达到新平衡时,CO的转化率
增大
增大
(填“增大”、“不变”或“减小”)(2011?浦东新区一模)某课题小组为了探究CO2是否在有水同时存在的情况下才能和Na2O2发生释放O2的反应,设计了如下装置,并采用两个方案进行对比实验.

方案一:干燥的CO2与Na2O2反应
操作方法是:在干燥的试管Ⅱ中装入Na2O2,在通入CO2之前,关闭K1和K2.在试管Ⅰ内装入试剂X后,打开K1和K2,通入CO2,过后将带火星的木条插入试管Ⅲ的液面上方,观察木条是否复燃和试管Ⅱ中淡黄色有无变化.
方案二:××××××
在试管Ⅰ内加入Y,其余操作同方案一.
请回答下列有关问题:
(1)方案二的实验名称可以是
(2)装入Na2O2,在通入CO2之前,关闭K1和K2的目的是
(3)方案一中试剂X是
(4)试管Ⅲ中的NaOH溶液用于吸收过量的CO2,防止其干扰带火星的木条复燃.但有人认为这仍显不足,担心水汽也会干扰复燃,建议将Ⅲ改成另一装置.你认为改用什么装置较好,请在右面的方框中将其画出,并标明所用试剂名称或化学式.
(5)为使实验结论更准确无误,本实验中制取CO2气体所用的反应物最好选用下列中的
a.大理石 b.小苏打 c.烧碱 d.盐酸 e.稀硫酸 f.稀硝酸.
查看习题详情和答案>>

方案一:干燥的CO2与Na2O2反应
操作方法是:在干燥的试管Ⅱ中装入Na2O2,在通入CO2之前,关闭K1和K2.在试管Ⅰ内装入试剂X后,打开K1和K2,通入CO2,过后将带火星的木条插入试管Ⅲ的液面上方,观察木条是否复燃和试管Ⅱ中淡黄色有无变化.
方案二:××××××
在试管Ⅰ内加入Y,其余操作同方案一.
请回答下列有关问题:
(1)方案二的实验名称可以是
潮湿的CO2与Na2O2反应
潮湿的CO2与Na2O2反应
;(2)装入Na2O2,在通入CO2之前,关闭K1和K2的目的是
防止Na2O2受潮
防止Na2O2受潮
;(3)方案一中试剂X是
浓H2SO4
浓H2SO4
.方案二中所用Y可以是蒸馏水
蒸馏水
.(4)试管Ⅲ中的NaOH溶液用于吸收过量的CO2,防止其干扰带火星的木条复燃.但有人认为这仍显不足,担心水汽也会干扰复燃,建议将Ⅲ改成另一装置.你认为改用什么装置较好,请在右面的方框中将其画出,并标明所用试剂名称或化学式.
(5)为使实验结论更准确无误,本实验中制取CO2气体所用的反应物最好选用下列中的
be
be
(填字母编号).a.大理石 b.小苏打 c.烧碱 d.盐酸 e.稀硫酸 f.稀硝酸.
将过量的气体通入到一种溶液中,最终一定能产生沉淀的是( )
①二氧化硫通入到硝酸钡溶液中 ②二氧化氮通入到四羟基合铝酸钠溶液中
③二氧化碳和氨气共同通入到氯化钙溶液中 ④硫化氢通入到氯化铝溶液中.
①二氧化硫通入到硝酸钡溶液中 ②二氧化氮通入到四羟基合铝酸钠溶液中
③二氧化碳和氨气共同通入到氯化钙溶液中 ④硫化氢通入到氯化铝溶液中.
查看习题详情和答案>>
某课外活动小组设计如图1所示装置,进行氯气制备及有关性质验证的实验.

(1)在实验时打开A中分液漏斗的活塞后,漏斗中的液体没有顺利流下,其可能原因是 ,装置A中发生反应的离子方程式为 .
(2)上述装置中明显存在不足之处,为保证装置B中实验成功,应在装置A、B之间添加一个装置,该装置是图2中的 (填“Ⅰ”、“Ⅱ”或“Ⅲ”).
(3)装置C中溶液发生的颜色变化为 ,请在方框内写出导致该阶段颜色变化的粒子符号.
,请在方框内写出导致该阶段颜色变化的粒子符号.
(4)装置D中起始的实验现象是 .
(5)某同学认为SO2和Cl2都有漂白性,二者混合后的漂白性会更强,他们将制得的SO2和Cl2同时通入到品红溶液中,结果褪色效果没有预期那样快.为了探讨SO2和Cl2按1:1通入的漂白效果,他们设计了如图3所示实验装置.
①实验开始后,乙装置中出现的现象是 ;
②用离子方程式表示乙中产生该现象的原因: .
查看习题详情和答案>>

(1)在实验时打开A中分液漏斗的活塞后,漏斗中的液体没有顺利流下,其可能原因是
(2)上述装置中明显存在不足之处,为保证装置B中实验成功,应在装置A、B之间添加一个装置,该装置是图2中的
(3)装置C中溶液发生的颜色变化为
 ,请在方框内写出导致该阶段颜色变化的粒子符号.
,请在方框内写出导致该阶段颜色变化的粒子符号.(4)装置D中起始的实验现象是
(5)某同学认为SO2和Cl2都有漂白性,二者混合后的漂白性会更强,他们将制得的SO2和Cl2同时通入到品红溶液中,结果褪色效果没有预期那样快.为了探讨SO2和Cl2按1:1通入的漂白效果,他们设计了如图3所示实验装置.
①实验开始后,乙装置中出现的现象是
②用离子方程式表示乙中产生该现象的原因:
SO2常用于制硫酸,其中一步重要的反应为2SO2(g)+O2(g)?2SO3(g)△H<0.若向一个2L的密闭容器中充入0.4mol SO2、0.2mol O2和0.4mol SO3发生上述反应.
请回答下列问题:
(1)当反应达到平衡时,各物质的浓度可能是(填序号).
A.c(SO2)=0.3mol/L、c(O2)=0.15mol/L
B.c(SO3)=0.4mol/L
C.c(O2)=0.2mol/L或c(SO2)=0.4mol/L
D.c(SO3)=0.3mol/L
(2)任选上述一种可能的情况,计算达到平衡时的平衡常数为
(3)某温度时,将4mol SO2和2mol O2通入2L密闭容器中,10min时反应达到平衡,SO2的转化率为80%,则0~10min内的平均反应速率v(O2)=
查看习题详情和答案>>
请回答下列问题:
(1)当反应达到平衡时,各物质的浓度可能是(填序号).
A.c(SO2)=0.3mol/L、c(O2)=0.15mol/L
B.c(SO3)=0.4mol/L
C.c(O2)=0.2mol/L或c(SO2)=0.4mol/L
D.c(SO3)=0.3mol/L
(2)任选上述一种可能的情况,计算达到平衡时的平衡常数为
0.74
0.74
.(3)某温度时,将4mol SO2和2mol O2通入2L密闭容器中,10min时反应达到平衡,SO2的转化率为80%,则0~10min内的平均反应速率v(O2)=
0.08mol/(L?min)
0.08mol/(L?min)
,该温度下反应2SO2(g)+O2(g)?2S03(g)的平衡常数K=80
80
.