网址:http://m.1010jiajiao.com/timu_id_4411961[举报]
用砂纸擦后的镁带丐沸水反应,再向反应后溶液中滴加酚酞溶液向新制的H2S饱和溶液中滴加新制的氯水钠与润滴有酚酞的冷水反应镁带与2mol·L-1盐酸反应铝条与2mol·L-1盐酸反应向ALCI3溶液中滴加NaOH溶液至过量
A. 浮于水面,熔成闪亮的小球,四边游动,逐渐缩小,溶液变红色
B. 产生大量的气体,气体可燃,溶液变浅红色
C. 反应+分剧烈,产生的气体可燃
D. 剧烈反应,产生的气体可燃
E. 生成白色胶状沉淀,继而沉淀消失
F. 生成淡黄色沉淀
(3)实验内容:
实验方案 实验现象 有关化学方程
(4)实验结论:________。
(5)问题讨论:①请从结构理论上简单说明上述结论的原因。
②请你补充一组实验方案(简单易行),证明此周期中另两种主族元素的性质递变规律。
现有下列短周期元素性质的数据:
元素编号
元素性质 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
原子半径
(10-10m) 0.74 1.60 1.52 1.10 0.99 1.86 0.75 0.82
最高和最
低化合价 +2 +1 +5 +7 +1 +5 +3
-2 -3 -1 -3
试回答下列问题:
(1)上述元素中处于同一主族的有________,元素②在周期表中的位置为________。
(2)上表中某两种元素,形成的分子中,每个原子都满足最外层为8电子的稳定结构,写出其电子式________。
(3)元素①⑥能形成两种化合物,写出其中较稳定的化,合物与水反应的,离子方程式:________。
查看习题详情和答案>>
A. 浮于水面,熔成闪亮的小球,四边游动,逐渐缩小,溶液变红色
B. 产生大量的气体,气体可燃,溶液变浅红色
C. 反应+分剧烈,产生的气体可燃
D. 剧烈反应,产生的气体可燃
E. 生成白色胶状沉淀,继而沉淀消失
F. 生成淡黄色沉淀
(3)实验内容:
实验方案 实验现象 有关化学方程
(4)实验结论:________。
(5)问题讨论:①请从结构理论上简单说明上述结论的原因。
②请你补充一组实验方案(简单易行),证明此周期中另两种主族元素的性质递变规律。
现有下列短周期元素性质的数据:
元素编号
元素性质 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
原子半径
(10-10m) 0.74 1.60 1.52 1.10 0.99 1.86 0.75 0.82
最高和最
低化合价 +2 +1 +5 +7 +1 +5 +3
-2 -3 -1 -3
试回答下列问题:
(1)上述元素中处于同一主族的有________,元素②在周期表中的位置为________。
(2)上表中某两种元素,形成的分子中,每个原子都满足最外层为8电子的稳定结构,写出其电子式________。
(3)元素①⑥能形成两种化合物,写出其中较稳定的化,合物与水反应的,离子方程式:________。
查看习题详情和答案>>
A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题
(1)常温下,X、Y的水溶液的pH均为5。则两种水溶液中由水电离出的H+浓度之比是 。
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式 。
(3)将铝片和镁片用导线相连,插入由A、D、E三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为 。
(4)化学反应3A2(g)+C2(g) ![]() 2CA3(g)。当反应达到平衡时不断
2CA3(g)。当反应达到平衡时不断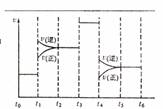
改变条件(不改变A2、C2和CA3的量),右图表示反应速度与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是 。温度为T℃时,将4amolA2和2amolC2放入密闭容器中,充分
反应后测得C2的转化率为50%,则反应的平衡常数 。
(5)化合物A8B4D2有如下转化关系:
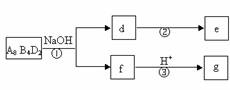
其中,g是常用调味品的主要成分。写出反应①的化学方程式
。
设计实验方案完成d→e的转化
。
查看习题详情和答案>>(1)下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准)。
烯类化合物 | 相对速率 |
(CH3)2C=CHCH3 | 10.4 |
CH3CH=CH2 | 2.03 |
CH2=CH2 | 1.00 |
CH2=CHBr | 0.04 |
据表中数据,总结烯类化合物加溴时,反应速率与C=C上取代基的种类、个数间的关系:
(2)下列化合物与氯化氢加成时,取代基对速率的影响与上述规律类似,其中反应速率最慢的是______________(填代号)。
A、(CH3)2C=C(CH3) 2 B、CH3CH=CH CH3
C、CH2=CH2 D、CH2=CHCl
(3)烯烃与溴化氢、水加成时,产物有主次之分,例如:
CH2=CHCH3 + HBr → CH3CHBrCH3 + CH3CH2CH2Br
(主要产物) (次要产物)
CH2=CH CH2CH3 + H2O → CH3CH(OH)CH2CH3 + CH3CH2CH2 CH2 OH
(主要产物) (次要产物)
化学式为C4H8的某烃A与HBr加成的主要产物中只含有一种氢原子。用结构简式表示A发生的反应方程式:
A 与水生成主要产物的反应
A的聚合反应
查看习题详情和答案>>5KCl+KClO3+3H2O。

请回答下列问题:
(1)B中的液体是________,其作用是________________________________________;
(2)已知C杯中装的是水,D管内装的是15mL30%KOH溶液,这种水浴加热方法的优点是________________,通过什么现象可以观察到KOH基本反应完毕___________________
__________________。
(3)E处管口塞着一团棉纱(已用Na2S2O3溶液浸湿),作用是利用其还原性吸收多余的Cl2,反应的离子方程式为________________________。
(4)已知KCl和KClO3在水中的溶解度如下表:
温度/℃ 0 20 40 60 80 100
KCl/℃ 27.6 34 40 45 51.1 56.7
KclO3/g 3.3 7 14 24.5 38.5 57
待D管内KOH基本反应完时,取所得混合溶液直接加热浓缩,则首先从溶液中析出的晶体是________________,当蒸发适量水后,趁热过滤,然后将滤液冷却,这时析出的晶体主要是________________________,欲进一步提纯KClO3,应采用的方法是________________
____________________。
查看习题详情和答案>>