网址:http://m.1010jiajiao.com/timu_id_4411533[举报]
B.3
C.5
D.6
下列关于有机实验说法正确的是
- A.苯甲酸的重结晶实验中要得到纯净的苯甲酸固体需要进行两次过滤操作
- B.实验室制乙烯时,为减弱浓硫酸对有机物的碳化作用,应用小火缓慢加热
- C.在石油的分馏、制硝基苯、制乙烯的实验中,都要使温度计的水银液泡浸入反应液中,以控制实验温度
- D.制备硝基苯,混合药品的顺序为:向试管中先加入苯,再加入浓硫酸,最后加入浓硝酸
某实验小组欲测定KMnO4的分解率α,但加热前忘记称量KMnO4的质量。面对此情况,甲同学采用下述方法:在加热时,利用浓盐酸与KMnO4受热部分分解后所得的固体混合物反应产生的Cl2被碱石灰吸收,通过碱石灰增重来计算KMnO4的分解率α。(与热的浓盐酸反应时,固体混合物中的Mn元素均被还原成Mn2+)

取KMnO4受热部分分解后所得的固体混合物mg进行实验,请从k@s^5*u上图中选用所需的仪器(可重复选用)组成一套反应装置,其它固、液试剂自选。(其中某些连接和固定仪器用的
玻璃管、胶管、铁夹、铁架台及加热装置、打气筒等均略去)
(1)在反应发生前,为了消除装置内空气中酸性气体的影响,须用打气筒向装置内鼓入一定量的空气。请你在下表中填写完成本实验时各装置的连接次序及药品。
| 各装置连接次序 | A | C | C | |||
| 对应的药品 | d:浓盐酸 e:固体混合物 | 碱石灰 | 碱石灰 |
(2)k@s^5*u上述高锰酸钾受热部分分解后所得固体混合物中K2MnO4与MnO2物质的量之比是 。
(3)当A装置内反应结束后,关闭分液漏斗活塞,打开止水夹k,再一次用打气筒向装置内鼓入一定量空气,其目的是 。
(4)若测得碱石灰增重ng。为了计算KMnO4的分解率α,该同学采用方法如下:设原mg的固体混合物中KMnO4及MnO2的物质的量分别为x、y,依据实验数据m及n,可列出三个含x、y、α的等式,请你写出这三个等式。(注意:等式中不用带单位)
仅含m、x、y的等式①:m= 。
仅含 n、x、y的等式②:n= 。
仅含α、x、y的等式③:α= 。
(5)另一同学设计更为简单的方法(无须化学反应)也可测定KMnO4的分解率α。
该同学的方法是:称取一定量KMnO4受热部分分解后所得的固体混合物,置于盛有适量蒸馏水的烧杯中,充分搅拌,再进行“一系列实验操作”并记录实验数据,最后经计算,即可得出KMnO4的分解率α。该同学的“一系列实验操作”是指 。
查看习题详情和答案>>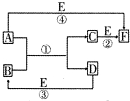 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物均未列出).
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物均未列出).(1)若A、D、E是短周期的非金属单质,且A、D所含元素同主族,A、E含元素同周期,已知D单质在电子工业中有重要作用,则D的原子结构示意图为
(2)若A、D为常见金属单质,且加热时A、D才能溶解在E的浓溶液中,写出反应③的化学方程式
部分含钒物质在水中的溶解性如下表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |

请回答下列问题:
(1)请写出加入Na2SO3溶液发生反应的离子方程式
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如下左图).
 其中a、c二步的化学方程式可表示为
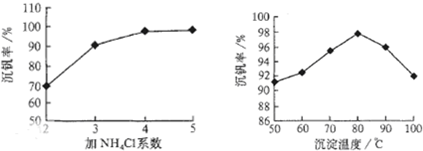
其中a、c二步的化学方程式可表示为(3)该工艺中沉矾率是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.
根据图试建议控制氯化铵系数和温度:
(4)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如右图所示.
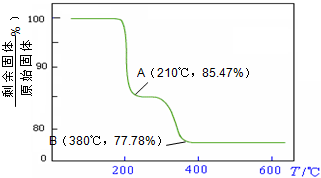 则NH4VO3在分解过程中
则NH4VO3在分解过程中A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O.