摘要:化学平衡状态的判断 化学平衡状态的标志:v正=v逆,平衡混合物中各组成成分的含量保持不变.“v正=v逆 是化学平衡的本质特征.其含意是反应体系中同一物质的消耗速率和生成速率相等.而各组分的含量“不变 .是指各组分的浓度.质量分数.体积分数.反应物的转化率等均保持不变.不变不能理解为相等. 判断某一可逆反应是否达到平衡状态的“等价标志 : (1)对于反应前后气体体积不等的反应.当恒温.恒容时.压强不变.气体的平均相对分子质量不变.或恒温.恒压时.体积不变.混合气体的密度不变.说明反应处于平衡状态. (2)对于有颜色物质参加的反应.体系颜色不变.说明反应处于平衡状态. (3)对于吸热或放热反应.绝热体系的温度不变.说明反应处于平衡状态.
网址:http://m.1010jiajiao.com/timu_id_4411529[举报]
化学平衡状态I、II、Ⅲ的相关数据如下表:
根据以上信息判断,下列结论错误的是( )
| 编号 | 化学方程式 | 平衡常数 | 温度 | |
| 979K | 1173K | |||
| Ⅰ | Fe(s)+CO2?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| Ⅱ | CO(g)+H2O(g)?CO2(g)+H2(g) | K2 | 1.62 | b |
| Ⅲ | Fe(s)+H2O(g)? FeO(s)+H2(g) |
K3 | a | 1.68 |
| A、a>b |
| B、增大压强;平衡状态II不移动 |
| C、升高温度平衡状态Ⅲ向正反应方向移动 |
| D、反应Ⅱ,Ⅲ均为放热反应 |
化学平衡状态I、Ⅱ、Ⅲ的相关数据如下表:
根据以上信息判断,下列结论错误的是( )
| 编号 | 化学方程式 | 平衡常数 | 温度 | |
| 979K | 1173K | |||
| Ⅰ | Fe(s)+CO2?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| Ⅱ | CO(g)+H2O(g)?CO2(g)+H2(g) | K2 | 1.62 | b |
| Ⅲ | Fe(s)+H2O(g)? FeO(s)+H2(g) |
K3 | a | 1.68 |
| A、a>b |
| B、升高温度平衡状态Ⅲ向正反应方向移动 |
| C、增大压强;平衡状态Ⅱ不移动 |
| D、反应Ⅱ、Ⅲ均为放热反应 |
化学平衡状态I、II、III的相关数据如下表:
| 编号 | 化学方程式 | 平衡常数 | 温度 | |
| 979K | 1173K | |||
| I | Fe(s)+CO2(g) 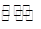 2 FeO(s)+CO(g) 2 FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| II | CO(g)+H2O(g) 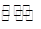 CO2(g)+H2(g) CO2(g)+H2(g) | K2 | 1.62 | b |
| III | Fe(s)+H2O(g)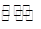 FeO(s)+H2(g) FeO(s)+H2(g) | K3 | a | 1.68 |
A.a>b B.增大压强,平衡状态II不移动
C.升高温度平衡状态III向正反应方向移动 D.反应II、III均为放热反应 查看习题详情和答案>>
化学平衡状态I、II、Ⅲ的相关数据如下表: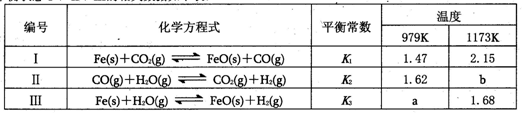
根据以上信息判断,下列结论错误的是
| A.a>b |
| B.升高温度平衡状态Ⅲ向正反应方向移动 |
| C.增大压强;平衡状态II不移动 |
| D.反应II、Ⅲ均为放热反应 |