题目内容
化学平衡状态I、II、Ⅲ的相关数据如下表:
根据以上信息判断,下列结论错误的是( )
| 编号 | 化学方程式 | 平衡常数 | 温度 | |
| 979K | 1173K | |||
| Ⅰ | Fe(s)+CO2?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| Ⅱ | CO(g)+H2O(g)?CO2(g)+H2(g) | K2 | 1.62 | b |
| Ⅲ | Fe(s)+H2O(g)? FeO(s)+H2(g) |
K3 | a | 1.68 |
| A、a>b |
| B、增大压强;平衡状态II不移动 |
| C、升高温度平衡状态Ⅲ向正反应方向移动 |
| D、反应Ⅱ,Ⅲ均为放热反应 |
分析:分析Ⅰ、Ⅱ、Ⅲ反应的平衡常数表达式,图表数据计算计算K3分析判断;
A、依据计算出色平衡常数ab分析判断大小;
B、反应Ⅱ是气体体积不变的反应,增大压强平衡不动;
C、依据平衡常数随温度变化分析判断反应能量变化,结合平衡移动原理分析;
D、通过计算出的平衡常数,结合平衡常数随温度的变化判断反应能量变化;
A、依据计算出色平衡常数ab分析判断大小;
B、反应Ⅱ是气体体积不变的反应,增大压强平衡不动;
C、依据平衡常数随温度变化分析判断反应能量变化,结合平衡移动原理分析;
D、通过计算出的平衡常数,结合平衡常数随温度的变化判断反应能量变化;
解答:解:Fe(s)+CO2?FeO(s)+CO(g),K1=
,
CO(g)+H2O(g)?CO2(g)+H2(g),K2=
,
Fe(s)+H2O(g)?FeO(s)+H2(g),K3=
,
同温度下,K2=
,K3=K1?K2,979K平衡常数a=1.47×1.62=2.38,1173K平衡常数b=
=0.78,
A、计算分析可知a>b,故A正确;
B、反应ⅡCO(g)+H2O(g)?CO2(g)+H2(g),是气体体积不变的反应,增大压强平衡不动,故B正确;
C、计算得到平衡常数,反应Ⅲ平衡常数随温度升高减小,平衡逆向进行,故C错误;
D、反应Ⅱ的平衡常数随温度升高减小,说明正反应为放热反应,反应Ⅲ平衡常数随温度升高减小,说明正反应为放热反应,故D正确;
故选C.
| c(CO) |
| c(CO2) |
CO(g)+H2O(g)?CO2(g)+H2(g),K2=
| c(CO2)c(H2) |
| c(CO)c(H2O) |
Fe(s)+H2O(g)?FeO(s)+H2(g),K3=
| c(H2) |
| c(H2O) |
同温度下,K2=
| K3 |
| K1 |
| 1,68 |
| 2.15 |
A、计算分析可知a>b,故A正确;
B、反应ⅡCO(g)+H2O(g)?CO2(g)+H2(g),是气体体积不变的反应,增大压强平衡不动,故B正确;
C、计算得到平衡常数,反应Ⅲ平衡常数随温度升高减小,平衡逆向进行,故C错误;
D、反应Ⅱ的平衡常数随温度升高减小,说明正反应为放热反应,反应Ⅲ平衡常数随温度升高减小,说明正反应为放热反应,故D正确;
故选C.
点评:本题考查了化学平衡常数计算应用,注意图表数据的分析判断,注意相同温度下计算平衡常数减小比较,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
(1)某同学为探究蔗糖的水解反应,进行如下实验,填写实验步骤III的实验现象:
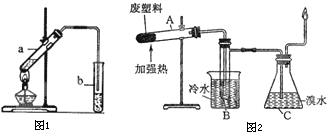
(2)“酒是陈的香”的原因之一是储存过程中生成了有香味的酯.实验室用下图所示装置制取乙酸乙酯.
①试管a中生成乙酸乙酯的化学反应方程式是 .
②试管b中盛放的试剂是 溶液
③若要把b中制得的乙酸乙酯从混合物中分离出来,应采用的实验操作是 .
④生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) .
a单位时间里,生成1mol乙酸乙酯,同时生成1mol水
b单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
c单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
d正反应的速率与逆反应的速率相等
e混合物中各物质的浓度不再变化
(3)加热聚丙烯塑料得到的产物如表:
实验装置如图所示.
①试管A中的最终残余物为 ;
②试管B收集到的产品中,有能使酸性高锰酸钾溶液褪色的物质,该物质的一氯代物有 种.
③锥形瓶C中观察到的现象是 ;经溴水充分吸收再干燥后,剩余两种气体的平均相对分子质量为 .

| 实验步骤 | 实验现象 |
| I.向编号为①②③的3支试管中,分别加入1mL 20%的蔗糖溶液,向试管②和③中加入0.5mL稀硫酸,并将这3支试管同时水浴加热约5min | 均无明显现象 |
| II.取试管①和②,加入新制氢氧化铜悬浊液,加热至沸腾 | 均无明显现象 |
| III.取试管③,先加入NaOH溶液调溶液pH至碱性,再加入新制氢氧化铜悬浊液,加热至沸腾 | |
| 结论:证明蔗糖在稀硫酸作用下发生了水解反应 | |
①试管a中生成乙酸乙酯的化学反应方程式是
②试管b中盛放的试剂是
③若要把b中制得的乙酸乙酯从混合物中分离出来,应采用的实验操作是
④生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)
a单位时间里,生成1mol乙酸乙酯,同时生成1mol水
b单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
c单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
d正反应的速率与逆反应的速率相等
e混合物中各物质的浓度不再变化
(3)加热聚丙烯塑料得到的产物如表:
| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
①试管A中的最终残余物为
②试管B收集到的产品中,有能使酸性高锰酸钾溶液褪色的物质,该物质的一氯代物有
③锥形瓶C中观察到的现象是
 I.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb).
I.描述弱电解质电离情况可以用电离度和电离平衡常数表示,下表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb).