摘要:一定温度下.在容积为1L的密闭容器中进行反应:aN(g)bM(g) △H<0.M.N的物质的量随时间的变化曲线如图所示: (1)此反应的化学方程式中= . (2)从t1到t2时刻.以M的浓度变化表示的平均反应速率为 .t2时两线的交叉点 平衡状态.此时v正 (填“> .“< 或“= )v逆. (3)下列描述中能说明上述反应达到平衡状态的是 A. 容器中M与N的物质的量之比为1:1 B. 混合气体的密度不随时间的变化而变化 C. 混合气体的总物质的量不随时间的变化而变化 D. 单位时间内消耗a molN的同时生成bmol M E. 混合气体的压强不随时间的变化而变化
网址:http://m.1010jiajiao.com/timu_id_4410927[举报]
在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ
测得CO2和CH3OH(g)的浓度随时间变化如图所示:
(1)从反应开始到第10min,氢气的平均反应速率v(H2)=______,在这段时间内,反应放出的热量=______.
(2)在该条件下,反应的平衡常数K的值=______(保留2位小数),如果在某一时刻保持温度不变,只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,则平衡______(填写序号).
a.向正反应方向移动 b.向逆反应方向移动
c.不移动 d.无法确定平衡移动方向
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是______(填写序号).
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离 d.再充入1mol CH3OH(g)
(4)在催化剂的作用下,CO2与H2能够合成许多物质,如甲醇.烃类.二甲醚等,但反应体系中混入杂质,则反应很难进行,可能的原因是______.
 查看习题详情和答案>>
查看习题详情和答案>>
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ
测得CO2和CH3OH(g)的浓度随时间变化如图所示:
(1)从反应开始到第10min,氢气的平均反应速率v(H2)=______,在这段时间内,反应放出的热量=______.
(2)在该条件下,反应的平衡常数K的值=______(保留2位小数),如果在某一时刻保持温度不变,只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,则平衡______(填写序号).
a.向正反应方向移动 b.向逆反应方向移动
c.不移动 d.无法确定平衡移动方向
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是______(填写序号).
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离 d.再充入1mol CH3OH(g)
(4)在催化剂的作用下,CO2与H2能够合成许多物质,如甲醇.烃类.二甲醚等,但反应体系中混入杂质,则反应很难进行,可能的原因是______.
 查看习题详情和答案>>
查看习题详情和答案>>
在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ
测得CO2和CH3OH(g)的浓度随时间变化如图所示:
(1)从反应开始到第10min,氢气的平均反应速率v(H2)=______,在这段时间内,反应放出的热量=______.
(2)在该条件下,反应的平衡常数K的值=______(保留2位小数),如果在某一时刻保持温度不变,只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,则平衡______(填写序号).
a.向正反应方向移动 b.向逆反应方向移动
c.不移动 d.无法确定平衡移动方向
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是______(填写序号).
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离 d.再充入1mol CH3OH(g)
(4)在催化剂的作用下,CO2与H2能够合成许多物质,如甲醇.烃类.二甲醚等,但反应体系中混入杂质,则反应很难进行,可能的原因是______.
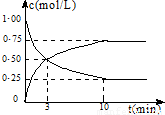 查看习题详情和答案>>
查看习题详情和答案>>
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ
测得CO2和CH3OH(g)的浓度随时间变化如图所示:
(1)从反应开始到第10min,氢气的平均反应速率v(H2)=______,在这段时间内,反应放出的热量=______.
(2)在该条件下,反应的平衡常数K的值=______(保留2位小数),如果在某一时刻保持温度不变,只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,则平衡______(填写序号).
a.向正反应方向移动 b.向逆反应方向移动
c.不移动 d.无法确定平衡移动方向
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是______(填写序号).
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离 d.再充入1mol CH3OH(g)
(4)在催化剂的作用下,CO2与H2能够合成许多物质,如甲醇.烃类.二甲醚等,但反应体系中混入杂质,则反应很难进行,可能的原因是______.
 查看习题详情和答案>>
查看习题详情和答案>>
在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ
测得CO2和CH3OH(g)的浓度随时间变化如图所示:
(1)从反应开始到第10min,氢气的平均反应速率v(H2)=______,在这段时间内,反应放出的热量=______.
(2)在该条件下,反应的平衡常数K的值=______(保留2位小数),如果在某一时刻保持温度不变,只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,则平衡______(填写序号).
a.向正反应方向移动 b.向逆反应方向移动
c.不移动 d.无法确定平衡移动方向
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是______(填写序号).
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离 d.再充入1mol CH3OH(g)
(4)在催化剂的作用下,CO2与H2能够合成许多物质,如甲醇.烃类.二甲醚等,但反应体系中混入杂质,则反应很难进行,可能的原因是______.
 查看习题详情和答案>>
查看习题详情和答案>>
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ
测得CO2和CH3OH(g)的浓度随时间变化如图所示:
(1)从反应开始到第10min,氢气的平均反应速率v(H2)=______,在这段时间内,反应放出的热量=______.
(2)在该条件下,反应的平衡常数K的值=______(保留2位小数),如果在某一时刻保持温度不变,只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,则平衡______(填写序号).
a.向正反应方向移动 b.向逆反应方向移动
c.不移动 d.无法确定平衡移动方向
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是______(填写序号).
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离 d.再充入1mol CH3OH(g)
(4)在催化剂的作用下,CO2与H2能够合成许多物质,如甲醇.烃类.二甲醚等,但反应体系中混入杂质,则反应很难进行,可能的原因是______.
 查看习题详情和答案>>
查看习题详情和答案>>
在1L容积固定的密闭容器中进行A、B、C、D四种气体间的反应,容器内各物质的物质的量随时间的变化如下表:
根据以上信息回答下列问题:
(1)该反应的化学方程式为: ;
(2)反应到第2min时,用B表示的平均反应速率为 mol?L-1?min-1;
(3)反应到第3min时,A物质的转化率为 ;
(4)实验表明升高温度该反应的平衡常数K值会减小,则该反应为 反应(填“放热”或“吸热”),在第4min时改变了某一条件,该条件可能是 ;
A.升温 B.增加B的浓度 C.使用催化剂 D.通入稀有气体
(5)下列能说明该反应达到平衡状态的是 .
A.反应停止了 B.2v(B)消耗=v(C)消耗
C.体系的密度保持不变 D.体系的压强保持不变.
查看习题详情和答案>>
| 时间/物质的量 | n(A)(mol) | n(B)(mol) | n(C)(mol) | n(D)(mol) |
| 起始 | 0.9 | 1.4 | 0 | 0.2 |
| 第1min | 0.6 | 1.1 | 0.15 | |
| 第2min | 0.4 | 0.9 | 0.25 | |
| 第3min | 0.3 | 0.8 | 0.8 | |
| 第4min | 0.3 | 0.8 | 0.3 | 0.8 |
| 第5min | 0.35 | 0.85 | 0.275 | 0.75 |
(1)该反应的化学方程式为:
(2)反应到第2min时,用B表示的平均反应速率为
(3)反应到第3min时,A物质的转化率为
(4)实验表明升高温度该反应的平衡常数K值会减小,则该反应为
A.升温 B.增加B的浓度 C.使用催化剂 D.通入稀有气体
(5)下列能说明该反应达到平衡状态的是
A.反应停止了 B.2v(B)消耗=v(C)消耗
C.体系的密度保持不变 D.体系的压强保持不变.
在一定温度下,向一个容积不变(1L)的密闭容器中,加入3mol PCl3和4mol Cl2使之发生反应PCl3(g)+Cl2(g)?PCl5(g),平衡时容器内压强为开始时的
.
计算并回答:
(1)平衡时,容器内气体密度是开始时的
倍.
(2)保持同一反应温度,若将起始物改为a mol PCl3,b mol Cl2,c mol PCl5.欲使平衡时PCl5的体积分数为
,则a,b,c满足的关系为
欲使开始时反应向逆方向进行,则a的取值范围为
(3)保持同一反应温度,若将起始物改为3mol PCl3,3mol Cl2,达到平衡时PCl3的转化率为
≈10.4)
查看习题详情和答案>>
| 6 |
| 7 |
计算并回答:
(1)平衡时,容器内气体密度是开始时的
1
1
倍,气体平均相对分子质量是开始时的| 7 |
| 6 |
| 7 |
| 6 |
(2)保持同一反应温度,若将起始物改为a mol PCl3,b mol Cl2,c mol PCl5.欲使平衡时PCl5的体积分数为
| 1 |
| 6 |
a+c=3
a+c=3
,b+c=4
b+c=4
.欲使开始时反应向逆方向进行,则a的取值范围为
0≤a<2
0≤a<2
,b的取值范围为1≤b<2
1≤b<2
,c的取值范围为1<c≤3
1<c≤3
(3)保持同一反应温度,若将起始物改为3mol PCl3,3mol Cl2,达到平衡时PCl3的转化率为
26.7%
26.7%
(百分数表示,保留一位小数;已知:| 108 |