网址:http://m.1010jiajiao.com/timu_id_44096[举报]
一、选择题(共30个小题,每小题1分,共30分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
答案
B
D
A
C
B
C
A
C
D
C
D
A
C
B
A
题号
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
答案
B
B
C
D
D
B
A
A
C
C
B
C
A
C
D
二、填空题(共5个小题,每空1分,共26分)
31.(7分)
(1)①ad,bc ②导电性
(2)①元素,无机盐 ②0.025;B
33.(7分)
(1)金属
(2)可燃性;氧气浓度低(或空气稀薄,或严寒,或低温,或气压低,或风速大)
(3)①9∶2
②C3H8+5O2 3CO2+4H2O
3CO2+4H2O
(4)环己烷;C6H12
33.(3分)
(1)甲>乙>丙
(2)t
t
甲乙物质的溶解度都随温度的升高而增大(其他答案合理即可给分)
(3)甲=乙>丙
34.(4分)
(1)酚酞
(2)A:Na2CO3 B:HCl
(3)Na2CO3+Ca(OH)2====CaCO3↓+2NaOH
(注:Na2CO3可相应换为K2CO3,Ca(OH)2可相应换为Ba(OH)2)
35.(5分)
(1)A:H2O2 乙:H2 E:CO
(2)2H2O2 2H2O+O2↑ 4CO+Fe3O4
2H2O+O2↑ 4CO+Fe3O4 3Fe+4CO2
3Fe+4CO2
三、实验题(共3个小题,每空1分,共18分)
36.(7分)
(1)长颈漏斗
(2)A;2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
(3)稀盐酸 浓硫酸 b
(4)可以随时控制气体的发生
37.(6分)
(1)A
(2)B;除去尾气中的CO2
(3)A;第一次是验证尾气中含有CO2,第二次是验证CO还原Fe2O3后有CO2生成,以此证明尾气中含有CO
(4)使煤充分燃烧,并注意通风排气(其他答案合理即可给分)
38.(5分)
(1)2Al+6HCl=2AlCl3+3H2↑
(3)
猜想假设
操作步骤
观察到的实验现象
相应的结论
取一只试管,加入一块铝片,然后加入少量30%的稀硫酸
铝片与稀硫酸反应是否需要加热?
温度对反应有影响
氯化钠
四、计算题(共2个小题,共6分)
39.(2分,每空1分)
(1)
(2)3 1分
40.(4分)
(1)4.4 1分
(2)CaCl2、HCl(有错项或不全不给分) 1分
(3)解:
设参加反应的碳酸钠的质量为x,反应生成的氯化钠的质量为y
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 73 111
x
 x=
x=
 y=
y=
烧杯里不饱和溶液中溶质的质量为:
答:略
金属是现代生活、工业生产以及科学研究中应用极为普遍的一类材料.
(1)青少年看书、写字一定要爱护眼睛,台灯是在光线不足时常用的照明用具.
①图1中标示的物质属于金属材料的有______(填序号).
②灯管后面的反光片为铝箔.铝块能制成铝箔是利用了铝的______性.
③铝比铁活泼,但铝箔却比铁螺丝钉耐腐蚀,其原因是______.
(2)已知在相同的条件下,金属的活动性越强,金属和酸反应产生气泡(氢气)的速度就越快.Mg、Cu、Fe三种金属在稀盐酸里的反应现象如图2所示.
①如图中Y所代表的金属是______(填“Mg”或“Cu”或“Fe”);
②Mg、Cu、Fe三种金属的活动性由强到弱的顺序为______;
(3)金属的开发和利用是人类文明和社会进步的标志.
①我国古代将炉甘石(ZnCO3)、赤铜矿(Cu2O)和木炭粉混合加热至800℃左右,即可得到与黄金外观相似的“药金”.
I.该方法不能制得金(Au)是因为______;
II.“药金”是______(填“纯金属”或“合金”);
②钛因常温下不与酸、碱反应等优良的性能,被誉为“未来金属”.由钒钛磁铁矿提取金属钛的主要工艺过程如下:
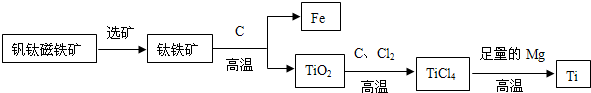
I.TiCl4在高温下与足量Mg反应置换生成金属Ti,该反应的化学方程式为:______.
II.上述生产过程中得到的金属钛中混有少量金属杂质,可加入______除去.
(4)已知某金属粉末中除含有Al外还含有一定量的Fe和Cu,为证明Fe和Cu的存在,某化学兴趣小组的同学展开了如下的实验探究.
资料在线:Al与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(反应的化学方程式为:2Al+2H2O+2NaOH═2NaAlO2+3H2↑),Fe和Cu不与氢氧化钠溶液反应.
请完成证明金属粉末中存在Fe和Cu的实验设计:
| 实验操作 | 实验现象 | 结论 |
| I.取少量的金属粉末于试管中,加入足量的______(填试剂名称). | ______ | 仅除去铝 |
| II.将试管静置,弃去上层清液,加入足量的稀硫酸. | ______ | 证明含有铁 |
| III.将试管静置,弃去上层清液,加水,多次洗涤剩余固体 | 剩余固体呈紫红色 | 证明含有铜 |
 金属材料在生活、生产中应用十分广泛。
金属材料在生活、生产中应用十分广泛。
(1)右图是金属铜的一个应用实例,利用了金属铜的_______性。
(2)铝制品在空气中不易锈蚀,原因是铝有“自我保护”作用,产生致密的保护膜,铝在空气中“自我保护”反应的化学方程式为______________。
 (3)铁制品很容易锈蚀。
(3)铁制品很容易锈蚀。
①某同学设计了下图所示的装置探究铁锈蚀的条件。a管中装入少量煮沸的蒸馏水,b管中是干燥的空气。调节L端与R端的液面高度一致,塞紧木塞。一段时间后观察。下列推断错误的是 。
A.只有a管中的铁钉会锈蚀
B.L端与R端的液面高度仍然保持一致
C.该实验不能说明铁生锈与空气有关
D.该实验说明铁的锈蚀与空气和水有关
②为了防止铁制品生锈,除了保持其清洁干燥或在其表面形成保护膜外,还可以 。
(4)若只用一种金属单质,两种盐溶液,来验证锌、铜、银三种金属活动性顺序,则验证过程中所涉及的化学方程式为____________________________。用铝丝与硫酸铜溶液反应完成“铜树”实验时,先要除去铝丝表面的氧化膜,常用的物理方法是__________,若用稀盐酸处理,当看到_________现象时,表明氧化膜已被破坏。
 (5)合成气(CO和H2)可用于制备被称为21世纪新型燃料的二甲醚(CH3OCH3),还可用于冶炼金属,其部分生产过程示意图如下:
(5)合成气(CO和H2)可用于制备被称为21世纪新型燃料的二甲醚(CH3OCH3),还可用于冶炼金属,其部分生产过程示意图如下:
①二甲醚(CH3OCH3)可由合成气(CO和H2)在一定的条件下制得。反应过程中CO和H2按分子个数比1∶2进行反应,制得二甲醚时,生成的另一种物质是 。
②根据示意图中标示的物质,合成气在冶炼铁的生产过程中发生了两个重要的反应,其中不属于置换反应的化学方程式为 。
查看习题详情和答案>>金属材料在生活、生产中应用十分广泛。
(1)下图是金属铜的一个应用实例,利用了金属铜的_______性。
(2)铝制品在空气中不易锈蚀,原因是铝有“自我保护”作用,产生致密的保护膜,铝在空气中“自我保护”反应的化学方程式为______________。
(3)铁制品很容易锈蚀。
①某同学设计了下图所示的装置探究铁锈蚀的条件。a管中装入少量煮沸的蒸馏水,b管中是干燥的空气。调节L端与R端的液面高度一致,塞紧木塞。一段时间后观察。下列推断错误的是 。
| A.只有a管中的铁钉会锈蚀 |
| B.L端与R端的液面高度仍然保持一致 |
| C.该实验不能说明铁生锈与空气有关 |
| D.该实验说明铁的锈蚀与空气和水有关 |
(4)若只用一种金属单质,两种盐溶液,来验证锌、铜、银三种金属活动性顺序,则验证过程中所涉及的化学方程式为____________________________。用铝丝与硫酸铜溶液反应完成“铜树”实验时,先要除去铝丝表面的氧化膜,常用的物理方法是__________,若用稀盐酸处理,当看到_________现象时,表明氧化膜已被破坏。
(5)合成气(CO和H2)可用于制备被称为21世纪新型燃料的二甲醚(CH3OCH3),还可用于冶炼金属,其部分生产过程示意图如下:

①二甲醚(CH3OCH3)可由合成气(CO和H2)在一定的条件下制得。反应过程中CO和H2按分子个数比1∶2进行反应,制得二甲醚时,生成的另一种物质是 。
②根据示意图中标示的物质,合成气在冶炼铁的生产过程中发生了两个重要的反应,其中不属于置换反应的化学方程式为 。 查看习题详情和答案>>

(1)青少年看书、写字一定要爱护眼睛,台灯是在光线不足时常用的照明用具.
①图1中标示的物质属于金属材料的有______(填序号).
②灯管后面的反光片为铝箔.铝块能制成铝箔是利用了铝的______性.
③铝比铁活泼,但铝箔却比铁螺丝钉耐腐蚀,其原因是______.
(2)已知在相同的条件下,金属的活动性越强,金属和酸反应产生气泡(氢气)的速度就越快.Mg、Cu、Fe三种金属在稀盐酸里的反应现象如图2所示.
①如图中Y所代表的金属是______(填“Mg”或“Cu”或“Fe”);
②Mg、Cu、Fe三种金属的活动性由强到弱的顺序为______;
(3)金属的开发和利用是人类文明和社会进步的标志.
①我国古代将炉甘石(ZnCO3)、赤铜矿(Cu2O)和木炭粉混合加热至800℃左右,即可得到与黄金外观相似的“药金”.
I.该方法不能制得金(Au)是因为______;
II.“药金”是______(填“纯金属”或“合金”);
②钛因常温下不与酸、碱反应等优良的性能,被誉为“未来金属”.由钒钛磁铁矿提取金属钛的主要工艺过程如下:
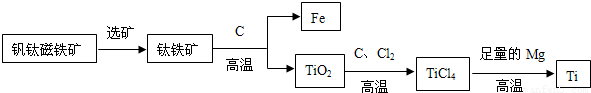
I.TiCl4在高温下与足量Mg反应置换生成金属Ti,该反应的化学方程式为:______.
II.上述生产过程中得到的金属钛中混有少量金属杂质,可加入______除去.
(4)已知某金属粉末中除含有Al外还含有一定量的Fe和Cu,为证明Fe和Cu的存在,某化学兴趣小组的同学展开了如下的实验探究.
资料在线:Al与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(反应的化学方程式为:2Al+2H2O+2NaOH═2NaAlO2+3H2↑),Fe和Cu不与氢氧化钠溶液反应.
请完成证明金属粉末中存在Fe和Cu的实验设计:
| 实验操作 | 实验现象 | 结论 |
| I.取少量的金属粉末于试管中,加入足量的______(填试剂名称). | ______ | 仅除去铝 |
| II.将试管静置,弃去上层清液,加入足量的稀硫酸. | ______ | 证明含有铁 |
| III.将试管静置,弃去上层清液,加水,多次洗涤剩余固体 | 剩余固体呈紫红色 | 证明含有铜 |
查看习题详情和答案>>

(1)青少年看书、写字一定要爱护眼睛,台灯是在光线不足时常用的照明用具.
①图1中标示的物质属于金属材料的有______(填序号).
②灯管后面的反光片为铝箔.铝块能制成铝箔是利用了铝的______性.
③铝比铁活泼,但铝箔却比铁螺丝钉耐腐蚀,其原因是______.
(2)已知在相同的条件下,金属的活动性越强,金属和酸反应产生气泡(氢气)的速度就越快.Mg、Cu、Fe三种金属在稀盐酸里的反应现象如图2所示.
①如图中Y所代表的金属是______(填“Mg”或“Cu”或“Fe”);
②Mg、Cu、Fe三种金属的活动性由强到弱的顺序为______;
(3)金属的开发和利用是人类文明和社会进步的标志.
①我国古代将炉甘石(ZnCO3)、赤铜矿(Cu2O)和木炭粉混合加热至800℃左右,即可得到与黄金外观相似的“药金”.
I.该方法不能制得金(Au)是因为______;
II.“药金”是______(填“纯金属”或“合金”);
②钛因常温下不与酸、碱反应等优良的性能,被誉为“未来金属”.由钒钛磁铁矿提取金属钛的主要工艺过程如下:
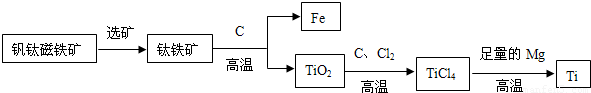
I.TiCl4在高温下与足量Mg反应置换生成金属Ti,该反应的化学方程式为:______.
II.上述生产过程中得到的金属钛中混有少量金属杂质,可加入______除去.
(4)已知某金属粉末中除含有Al外还含有一定量的Fe和Cu,为证明Fe和Cu的存在,某化学兴趣小组的同学展开了如下的实验探究.
资料在线:Al与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(反应的化学方程式为:2Al+2H2O+2NaOH═2NaAlO2+3H2↑),Fe和Cu不与氢氧化钠溶液反应.
请完成证明金属粉末中存在Fe和Cu的实验设计:
| 实验操作 | 实验现象 | 结论 |
| I.取少量的金属粉末于试管中,加入足量的______(填试剂名称). | ______ | 仅除去铝 |
| II.将试管静置,弃去上层清液,加入足量的稀硫酸. | ______ | 证明含有铁 |
| III.将试管静置,弃去上层清液,加水,多次洗涤剩余固体 | 剩余固体呈紫红色 | 证明含有铜 |
查看习题详情和答案>>