网址:http://m.1010jiajiao.com/timu_id_4402891[举报]
①CO(g)+
| 1 |
| 2 |
②H2(g)+
| 1 |
| 2 |
③CH3OH(g)+
| 3 |
| 2 |
④CO(g)+2H2(g)=CH3OH(g)
(1)反应④的△H=
(2)反应④中当CO(g)和H2(g) 起始浓度相同时,平衡常数K值越大,表明
a.反应物的转化率越高 b.反应进行得越完全
c.达到平衡时反应物的浓度越大 d.化学反应速率越快
(3)在一定条件下,反应④在一密闭容器中达到平衡.维持H2浓度和容器的温度不变,增大容器的体积,平衡将
A.向正反应方向移动 B.向逆反应方向移动
C.不移动 D.无法判断

(4)工业上用反应④低压合成甲醇,在230℃~270℃最为有利.为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如右图.230℃的实验结果所对应的曲线是
(17分)CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物。工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
(1) 已知:CH4、H2和CO的燃烧热分别为890.3kJ/mol、285.8kJ/mol和283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ。写出甲烷与水蒸气在高温下反应制取合成气的热化学方程式 。
(2)在一定条件下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
  时间/min 时间/min物质 浓度 | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2mol·L—1 | 0.13 mol·L—1 | 0.1 mol·L—1 | 0.1 mol·L—1 | 0.09 mol·L—1 |
| H2 | 0 mol·L—1 | 0.2 mol·L—1 | 0.3 mol·L—1 | 0.3 mol·L—1 | 0.33 mol·L—1 |
②3min时改变的反应条件是____________________(只填一种条件的改变)
(3)已知温度、压强、投料比X〔n(CH4)/n(H2O)〕对该反应的影响如图所示。

①图1中的两条曲线所示投料比的关系X1____X2(填“=”“>”或“<”下同)
②图2中两条曲线所示的压强比的关系:p1_______p2
(4)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池
①放电时,正极的电极反应式_______________________________________
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为 ____。 查看习题详情和答案>>
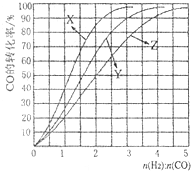 工业上常利用CO和H2合成可再生能源甲醇.
工业上常利用CO和H2合成可再生能源甲醇.(1)已知CO(g)、CH3OH(l)的燃烧热分别为283.0kJ?mol-1和726.5kJ?mol-1,则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为
(2)合成甲醇的方程式为CO(g)+2H2(g)?CH3OH(g)△H<0.在230℃?270℃最为有利.为研究合成气最合适的起始组成比n(H2):n(CO),分别在230℃、250℃和270℃进行实验,结果如图所示.其中270℃的实验结果所对应的曲线是
(3)当投料比为1:1,温度为230℃,平衡混合气体中,CH3OH的物质的量分数为
 CO+2H2的方法来制取高纯度的CO和H2。已知H2(g)、CO(g)和CH3OH(1)的燃烧热分别为285.8kJ/mol、283.0kJ/mol和726.5kJ/mol。请回答下列问题:
CO+2H2的方法来制取高纯度的CO和H2。已知H2(g)、CO(g)和CH3OH(1)的燃烧热分别为285.8kJ/mol、283.0kJ/mol和726.5kJ/mol。请回答下列问题:(1)反应CH3OH(1)=CO(g)+2H2(g)的△H=__________kJ/mol。
(2)标准状况下33.6LCO、H2的混合气体与足量氧气充芬反应后,将生成的CO2和水蒸气通入足量的Na2O2后,固体质量增加30.0g,则CO、H2的混合气体的平均相对分子质量为____________________________。
(3)利用反应H2(g)+CO(g)+O2(g)=H2O(g)+CO2(g)设计而成的MCFS燃料电池是一种新型电池,已知该该电池使用KOH溶液作电解质溶液,则正极的电极反应式为_____________。现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,则该电解总反应的离子方程式是________________。若电解100mL0.1mol/L的NaCl溶液,阴、阳两极各产生112mL气体(标准状况下),则所得溶液的pH为___________(忽略反应前后溶液的体积变化);若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400mL,当阳极产生672mL气体(标准状况下)时,阴极析出的固体质量为____________g。
工业上通常在恒容密闭容器中采用CO(g)和H2 (g)反应催化合成甲醇CH3OH(g):
(1)已知:① 2CO(g) + O2 (g) = 2CO2 (g) ΔH = -566.0 kJ·mol-1 ② 2H2(g) + O2 (g) =2 H2O (g) ΔH = -398.0 kJ·mol-1 ③2CH3OH(g) +3 O2 (g) =2CO2 (g) +4 H2O(g) ΔH = -1104.0 kJ·mol-1则CO(g)与H2(g)合成CH3OH(g)的热化学方程式是_______________。
(2)据研究,反应过程中起催化作用的为CuO,反应体系中含少量CO2有利于维持催化剂CuO的量不变,原因是:_______________________________ (用化学方程式表示)。
(3)判断反应达到平衡状态的依据是(填字母序号,下同)__________。
A. 混合气体的密度不变
B. 混合气体的平均相对分子质量不变
C. CH3OH(g)、CO(g)、H2(g)的浓度都不再发生变化
D.生成CH3OH(g)的速率与消耗CO(g)的速率相等
(4)下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.250 | 0.012 |
某温度下,将2molCO(g)和6mol H2(g)充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.5mol/L,则CO(g)的转化率为________,此时的温度为__________。
(5)要提高CO(g)的转化率,可以采取的措施是__________。
A. 升高温度 B. 加入催化剂 C. 增加CO(g)的浓度
D. 加入H2(g)加压 E. 分离出甲醇 F.加入惰性气体加压
(6)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO 2molH2 | 1molCH3OH | 2molCH3OH | |
| 平衡数据 | CH3OH的浓度(mol/L) | c 1 | c 2 | c 3 |
| 反应的能量变化的绝对值(kJ) | a | b | c | |
| 体系压强(Pa) | P1 | P2 | P3 | |
| 反应物转化率 | α1 | α2 | α3 | |
下列说法正确的是__________。
A. 2c1>c3 B. a+b=129 C. 2p2<p3 D. α1+α3<1
查看习题详情和答案>>