摘要:32.列强获得下列侵略权益的先后顺序是 ①协定关税 ②领事裁判权 ③划定使馆界 ④在通商口岸设厂 A.①②④③ B.①③④② C.④①②③ D.②③①④
网址:http://m.1010jiajiao.com/timu_id_4401231[举报]
铜及其化合物一般都具有特征的颜色,例如Cu、Cu2O呈红色,CuO呈黑色,CuSO4?5H2O呈蓝色等.研究性学习小组甲为检测实验室的Cu2O试样中是否含有Cu进行了认真的探究.
Ⅰ.查阅资料:①Cu2O属于碱性氧化物; ②在空气中灼烧Cu2O生成CuO;
③Cu2O在酸性条件下能发生自身氧化还原反应(Cu2O+2H+=Cu+Cu2++H2O).
Ⅱ.设计实验方案:
方案1:取该红色试样溶于足量的稀硝酸中,观察溶液颜色变化
方案2:取该红色试样溶于足量的稀硫酸中,观察是否有残渣
方案3:称得干燥坩埚的质量为a g,取红色试样置于坩埚中称得总质量为b g,在空气中充分灼烧至完全变黑,并在干燥器中冷却,再称量.如此反复多次直到质量不变,称得最后质量为c g.分析数据,作出合理判断.
(1)请你评价方案1和方案2.如果你认为该方案合理,请简述其工作原理;如果你认为该方案不合理,请简述原因.
(2)方案3中,如果a、b、c的关系符合c=
(b-a)
(b-a)可确认红色粉末是Cu2O
Ⅲ.研究性学习小组乙,设计了新的探究方案,装置如图所示.

(3)简述新探究方案中,气体发生装置的气密性如何检验(操作、现象、结论):
(4)你认为依据新方案测定上述红色试样成分必须获得下列哪些物理量:(选填序号)
③完全反应后红色固体+硬质试管的总质量;④实验前,干燥管(含药品)的质量;⑤硬质试管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后,干燥管(含药品)的质量
(5)有人提出,在氢气发生器与硬质试管之间应加一个干燥装置,你认为
查看习题详情和答案>>
Ⅰ.查阅资料:①Cu2O属于碱性氧化物; ②在空气中灼烧Cu2O生成CuO;
③Cu2O在酸性条件下能发生自身氧化还原反应(Cu2O+2H+=Cu+Cu2++H2O).
Ⅱ.设计实验方案:
方案1:取该红色试样溶于足量的稀硝酸中,观察溶液颜色变化
方案2:取该红色试样溶于足量的稀硫酸中,观察是否有残渣
方案3:称得干燥坩埚的质量为a g,取红色试样置于坩埚中称得总质量为b g,在空气中充分灼烧至完全变黑,并在干燥器中冷却,再称量.如此反复多次直到质量不变,称得最后质量为c g.分析数据,作出合理判断.
(1)请你评价方案1和方案2.如果你认为该方案合理,请简述其工作原理;如果你认为该方案不合理,请简述原因.
方案Ⅰ不合理,铜和氧化亚铜都能和硝酸生成Cu2+;方案Ⅱ不合理,Cu+在酸性条件下能发生自身氧化还原反应,也生成了铜单质
方案Ⅰ不合理,铜和氧化亚铜都能和硝酸生成Cu2+;方案Ⅱ不合理,Cu+在酸性条件下能发生自身氧化还原反应,也生成了铜单质
(2)方案3中,如果a、b、c的关系符合c=
| 10 |
| 9 |
| 10 |
| 9 |
Ⅲ.研究性学习小组乙,设计了新的探究方案,装置如图所示.

(3)简述新探究方案中,气体发生装置的气密性如何检验(操作、现象、结论):
关闭活塞,从长颈漏斗向试管中注入一定量的水,使漏斗内液面高于试管内液面,静置后若漏斗内液面不下降,则装置的气密性良好;液面下降,则装置漏气
关闭活塞,从长颈漏斗向试管中注入一定量的水,使漏斗内液面高于试管内液面,静置后若漏斗内液面不下降,则装置的气密性良好;液面下降,则装置漏气
(4)你认为依据新方案测定上述红色试样成分必须获得下列哪些物理量:(选填序号)
②③⑤
②③⑤
①通入氢气体积; ②反应前,红色试样+硬质试管的总质量;③完全反应后红色固体+硬质试管的总质量;④实验前,干燥管(含药品)的质量;⑤硬质试管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后,干燥管(含药品)的质量
(5)有人提出,在氢气发生器与硬质试管之间应加一个干燥装置,你认为
需要
需要
(选填“需要”或“不需要”),简述理由反应后,应让铜粉在氢气流中冷却,如没有干燥管,铜粉将吸湿
反应后,应让铜粉在氢气流中冷却,如没有干燥管,铜粉将吸湿
.
为证明化学反应有一定的限度,进行如下探究活动:
I.取5ml 0.1mol/L的KI溶液,滴加5-6滴FeCl3稀溶液;
Ⅱ.继续加入2mlCCl4振荡
Ⅲ.取萃取后的上层清液,滴加KSCN溶液.
(1)探究活动I的实验现象为 .
探究活动Ⅱ的实验现象为 .
(2)探究活动Ⅲ的意图是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色.对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察.
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大;
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高.
结合新信息,现设计以下实验方案验证猜想:
①请完成下表
②写出实验操作“步骤一”中的反应离子方程式: .
Ⅳ.为了测定探究活动I中的FeCl3稀溶液的浓度,现进行以下操作:
①移取25.00mLFeCl3稀溶液至锥形瓶中,加入 用作指示剂,再用c mol/LKI标准溶液滴定,达到滴定终点时的现象是 .
②重复滴定三次,平均耗用c mol/LKI标准溶液VmL,则FeCl3稀溶液物质的量浓度为 mol/L.
③若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果 (填“偏高”或“偏低”或“不变”).
查看习题详情和答案>>
I.取5ml 0.1mol/L的KI溶液,滴加5-6滴FeCl3稀溶液;
Ⅱ.继续加入2mlCCl4振荡
Ⅲ.取萃取后的上层清液,滴加KSCN溶液.
(1)探究活动I的实验现象为
探究活动Ⅱ的实验现象为
(2)探究活动Ⅲ的意图是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色.对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察.
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大;
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高.
结合新信息,现设计以下实验方案验证猜想:
①请完成下表
| 实验操作 | 现象和结论 |
| 步骤一: | 若产生蓝色沉淀,则 |
| 步骤二: | 若乙醚层呈血红色,则 |
Ⅳ.为了测定探究活动I中的FeCl3稀溶液的浓度,现进行以下操作:
①移取25.00mLFeCl3稀溶液至锥形瓶中,加入
②重复滴定三次,平均耗用c mol/LKI标准溶液VmL,则FeCl3稀溶液物质的量浓度为
③若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验.
实验Ⅰ反应产物的定性探究
按如图装置(固定装置已略去)进行实验
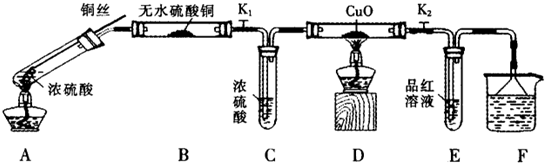
(1)F烧杯中的溶液是 .
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是 .
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是 .
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 .
(5)为说明浓硫酸中的水会否影响B装置现象的判断,还须进行一次实验.实验方案为 .
实验Ⅱ反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料.
资料1:
资料2:X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种.
仅由上述资料可得出的正确结论是 .
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15mol?L-1
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00mL溶液,取该溶液25.00mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol?L-1Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL.若反应消耗铜的质量为ag,则硫酸铜的产率为 .
(已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-) 查看习题详情和答案>>
实验Ⅰ反应产物的定性探究
按如图装置(固定装置已略去)进行实验

(1)F烧杯中的溶液是
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是
(3)实验结束时,撤去所有酒精灯之前必须完成的实验操作是
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是
(5)为说明浓硫酸中的水会否影响B装置现象的判断,还须进行一次实验.实验方案为
实验Ⅱ反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料.
资料1:
| 硫酸/mol?L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
仅由上述资料可得出的正确结论是
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15mol?L-1
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00mL溶液,取该溶液25.00mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol?L-1Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL.若反应消耗铜的质量为ag,则硫酸铜的产率为
(已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-) 查看习题详情和答案>>
(2011?上海模拟)为了证明化学反应有一定的限度,进行了如下探究活动:
(Ⅰ)取5mL0.1mol?L-1的KI溶液,滴加0.1mol?L-1的FeCl3溶液5~6滴
(Ⅱ)继续加入2mLCCl4振荡
(Ⅲ)取萃取后的上层清液,滴加KSCN溶液
(1)探究活动(Ⅰ)和(Ⅱ)的实验现象分别为
(2)在探究活动(Ⅲ)中,活动设计者的意图是通过生成血红色的Fe(SCN)3,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中,却未见溶液呈血红色,对此同学们提出了下列两种猜想.
猜想一:Fe3+已全部转化为Fe2+
猜想二:生成Fe(SCN)3浓度极小,其颜色肉眼无法观察
为了验证猜想,在查阅资料后,获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高
结合新信息,请你设计以下实验验证猜想
①请将相关的实验操作、现象和结论填入下表
②写出操作“步骤一”中发生反应的离子方程式
查看习题详情和答案>>
(Ⅰ)取5mL0.1mol?L-1的KI溶液,滴加0.1mol?L-1的FeCl3溶液5~6滴
(Ⅱ)继续加入2mLCCl4振荡
(Ⅲ)取萃取后的上层清液,滴加KSCN溶液
(1)探究活动(Ⅰ)和(Ⅱ)的实验现象分别为
溶液呈棕黄色
溶液呈棕黄色
、溶液分层,下层CCl4层呈紫色
溶液分层,下层CCl4层呈紫色
.(2)在探究活动(Ⅲ)中,活动设计者的意图是通过生成血红色的Fe(SCN)3,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中,却未见溶液呈血红色,对此同学们提出了下列两种猜想.
猜想一:Fe3+已全部转化为Fe2+
猜想二:生成Fe(SCN)3浓度极小,其颜色肉眼无法观察
为了验证猜想,在查阅资料后,获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高
结合新信息,请你设计以下实验验证猜想
①请将相关的实验操作、现象和结论填入下表
| 实验操作 | 现象 | 结论 |
| 步骤一: 取萃取后的上层清液滴加2-3滴 K4[Fe(CN)6]溶液 取萃取后的上层清液滴加2-3滴 K4[Fe(CN)6]溶液 |
产生蓝色沉淀 | 猜想一不成立 猜想一不成立 |
| 步骤二: 往探究活动III溶液中加入乙醚,充分振荡 往探究活动III溶液中加入乙醚,充分振荡 |
乙醚层呈血红色 乙醚层呈血红色 |
“猜想二”成立 |
4Fe3++3[Fe(CN)6]4-═Fe4[Fe(CN)6]3↓
4Fe3++3[Fe(CN)6]4-═Fe4[Fe(CN)6]3↓
.(15分)
为了证明化学反应有一定的限度,进行了如下探究活动:
(Ⅰ)取5mL0.1 mol·L-1的KI溶液,滴加0.1 mol·L-1的FeCl3溶液5~6滴
(Ⅱ)继续加入2mLCCl4振荡
(Ⅲ)取萃取后的上层清液,滴加KSCN溶液
(1)探究活动(Ⅰ)和(Ⅱ)的实验现象分别为_____________、 。
(2)在探究活动(Ⅲ)中,活动设计者的意图是通过生成血红色的Fe(SCN)3,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中,却未见溶液呈血红色,对此同学们提出了下列两种猜想。
猜想一:Fe3+已全部转化为Fe2+
猜想二:生成Fe(SCN)3浓度极小,其颜色肉眼无法观察
为了验证猜想,在查阅资料后,获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高
结合新信息,请你设计以下实验验证猜想
①请将相关的实验操作、现象和结论填入下表
| 实验操作 | 现象 | 结论 |
| 步骤一: | 产生蓝色沉淀 | |
| 步骤二: | | “猜想二”成立 |