网址:http://m.1010jiajiao.com/timu_id_433744[举报]
 铁、铝是现代金属材料的主角.
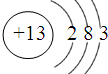
铁、铝是现代金属材料的主角.(1)写出Al的原子结构示意图

(2)已知:铝的燃烧热为1675kJ?mol-1;2Fe(s)+3/2O2(g)═Fe2O3(s);△H=-822kJ?mol-1;则2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s);△H=
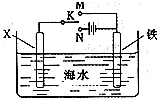
(3)利用如图装置,可以模拟铁的电化学防护.若X为碳棒,为减缓铁的腐蚀,开关K应该置于
(4)对金属制品进行抗腐蚀处理,可延长其使用寿命.铁制品表面镀铜可防止其腐蚀,电镀时为了补充溶液中消耗的Cu2+,保持溶液中Cu2+浓度恒定,则阳极材料必须为
①KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O,1:6
②2Al+2NaOH+2H2O═2NaAlO2+3H2↑,3:1
③SiO2+3C═SiC+2CO,1:2
④3NO2+H2O═2HNO3+NO,2:1.
LiBH4为近年来储氢材料领域的研究热点。
(1)反应2LiBH4=2LiH+2B+3H2↑,生成22.4 L H2(标准状况)时,转移电子的物质的量为???? mol。
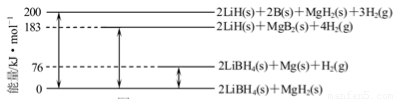
(2)下图是2LiBH4/MgH2体系放氢焓变示意图,则:
Mg(s)+2B(s)=MgB2(s) △H=???????? 。
(3)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:
①如图为25℃水浴时每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系图。由图可知,下列说法正确的是???? (填字母)。
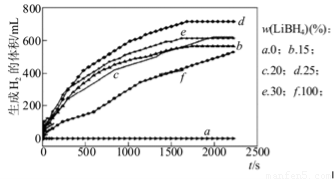
a.25℃时,纯铝与水不反应
b.25℃时,纯LiBH4与水反应产生氢气
c.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
②如图为25℃和75℃时,Al-LiBH4复合材料[ω(LiBH4)=25%]与水反应一定时间后产物的X-射线衍射图谱(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。
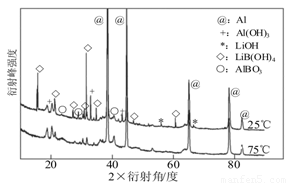
从图中分析,25℃时Al-LiBH4复合材料中与水完全反应的物质是? ??? ? ?? (填化学式),产生Al(OH)3的化学方程式为??? ???? ??? ??? 。
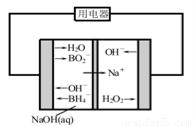
(4)如图是直接硼氢化钠-过氧化氢燃料电池示意图。该电池工作时,正极附近溶液的pH???????? (填“增大”、“减小”或“不变”),负极的电极反应式为??? ?????? ?? ???????? ? 。
查看习题详情和答案>>
(8分)查阅有关资料知:铝与氢氧化钠溶液反应实际是分以下两步进行:
第1步:2Al+6H2O=2Al(OH)3+3H2↑ 第2步:Al(OH)3+NaOH=Na[Al(OH)4]
试回答下列问题:
(1)铝与氢氧化钠溶液反应的离子方程式为: 。
(2)判断两步反应的反应类型(用四种基本反应类型作答)
①第1步属 ,②第2步属 。
(3)根据你的分析,铝与氢氧化钠溶液反应中氧化剂是 ,
还原剂是___________。
(4)若将 Na[Al(OH)4] +4HCl = AlCl3 + NaCl + 4H2O 分两步进行,请写出第1步的化学方程式。
第1步:
第2步:Al(OH)3 + 3HCl = AlCl3 + 3H2O
查看习题详情和答案>>
(8分)查阅有关资料知:铝与氢氧化钠溶液反应实际是分以下两步进行:
第1步:2Al+6H2O=2Al(OH)3+3H2↑ 第2步:Al(OH)3+NaOH=Na[Al(OH)4]
试回答下列问题:
(1)铝与氢氧化钠溶液反应的离子方程式为: 。
(2)判断两步反应的反应类型(用四种基本反应类型作答)
①第1步属 ,②第2步属 。
(3)根据你的分析,铝与氢氧化钠溶液反应中氧化剂是 ,
还原剂是___________。
(4)若将 Na[Al(OH)4] +4HCl = AlCl3 + NaCl + 4H2O 分两步进行,请写出第1步的化学方程式。
第1步:
第2步:Al(OH)3 + 3HCl = AlCl3 + 3H2O