摘要:C.
网址:http://m.1010jiajiao.com/timu_id_433678[举报]
C、CO、CH4、C2H5OH是常用的燃料,它们每1mol 分别完全燃烧生成CO2(g)及H2O(l)时,放出的热量依次为393.5kJ、283.0kJ、890.3kJ、1366.8kJ.相同质量的这4种燃料,完全燃烧时放出热量最多的是( )
查看习题详情和答案>>
C、D、G、I均为短周期元素形成的单质,D、G、I为常见非金属气态单质.D的最外层电子数是次外层电子数的3倍,C、G同周期,且最外层电子数相差4,它们的简单离子电子层结构不同.相互间有如下转化关系:
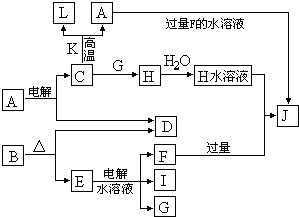
请填空:
(1)D与I能形成原子个数比为1:1的共价化合物,请写出其分子式:
G与I也能形成原子个数比为1:1的共价化合物,请写出其电子式: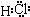
 .
.
(2)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,写出电解1L1mol?L-1的E水溶液的化学方程式:
(3)化合物K 中含有组成单质L的元素,且该元素的质量分数为70%.反应C→L的化学方程式是
(4)写出A+F→J的离子方程式:
查看习题详情和答案>>

请填空:
(1)D与I能形成原子个数比为1:1的共价化合物,请写出其分子式:
H2O2
H2O2
;G与I也能形成原子个数比为1:1的共价化合物,请写出其电子式:
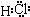
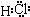
(2)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,写出电解1L1mol?L-1的E水溶液的化学方程式:
2KCl+2H2O
2KOH+Cl2↑+H2↑
| ||
2KCl+2H2O
2KOH+Cl2↑+H2↑
,当溶液的pH=13时,理论上生成G的单质在标准状况下的体积为
| ||
1.12L
1.12L
;若将上述两电极材料调换,则阳极上的电极反应为Fe-2e-=Fe2+
Fe-2e-=Fe2+
.(3)化合物K 中含有组成单质L的元素,且该元素的质量分数为70%.反应C→L的化学方程式是
Fe2O3+2Al
Al2O3+2Fe
| ||
Fe2O3+2Al
Al2O3+2Fe
| ||
(4)写出A+F→J的离子方程式:
Al2O3+2OH-=2AlO2-+H2O
Al2O3+2OH-=2AlO2-+H2O
.C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用.请回答下列问题:
(1)32号元素Ge的原子核外电子排布式为
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是
(3)已知SnO2是离子晶体,写出其主要物理性质
(4)已知:
分析上表中四种物质的相关数据,请回答:
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时
查看习题详情和答案>>
(1)32号元素Ge的原子核外电子排布式为
[Ar]3d104s24p2
[Ar]3d104s24p2
.(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是
Sn
Sn
.(3)已知SnO2是离子晶体,写出其主要物理性质
熔沸点较高,硬度较大
熔沸点较高,硬度较大
(写出2条即可).(4)已知:
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是
CH4和SiH4比较,相对分子质量越大,范德华力越大,故沸点高,而NH3和PH3比较前者分子间存在氢键沸点高
CH4和SiH4比较,相对分子质量越大,范德华力越大,故沸点高,而NH3和PH3比较前者分子间存在氢键沸点高
.②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是
分解破坏的均为共价键,C-H的键能大于Si-H的键能,N-H键的键能大于P-H键的键能
分解破坏的均为共价键,C-H的键能大于Si-H的键能,N-H键的键能大于P-H键的键能
.结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时
HF
HF
先液化.C、Si、S都是自然界中含量丰富的非金属元素,下列关于其单质及化合物的说法中正确的是( )
| A、三种元素在自然界中既有游离态又有化合态 | B、二氧化物都属于酸性氧化物,能与碱反应而不能与任何酸反应 | C、最低价的气态氢化物都具有还原性,易与O2发生反应 | D、其最高价氧化物对应水化物的酸性强弱:H2SO4>H2SiO3>H2CO3 |