网址:http://m.1010jiajiao.com/timu_id_428360[举报]
根据碘与氢气反应的热化学方程式,下列判断正确的是
① I2(g)+H2(g)![]() 2HI(g) △H=-9.48 kJ/mol
2HI(g) △H=-9.48 kJ/mol
② I2(s)+H2(g)![]() 2HI(g) △H=+26.48 kJ/mol
2HI(g) △H=+26.48 kJ/mol
(1)写出固态碘生成气态碘的热化学方程式 .
(2)写出反应 ① 平衡常数的表达式 。
(3)对于在恒温、恒容密闭容器中进行的反应①,能说明其达到化学平衡状态的是 。
A. 容器中气体压强不变 B. 容器中气体密度不变
C. 容器中气体颜色的深浅不变 D. 有n个H—H键断裂的同时有2n个H—I键断裂
(4)可通过反应2NO+O2=2NO2和NO2+2H++2I-=NO+I2+H2O来制取碘,NO在制碘过程中的作用是 。
查看习题详情和答案>>(10分)
(1)制备氢氧化铁胶体的化学方程式为 。
(2)碳酸氢钠在水溶液中的电离方程式为 。
(3)能证明Na2SO3溶液中存在SO32-+H2O HSO3-+OH-水解平衡的事实是 (填选项字母)。
HSO3-+OH-水解平衡的事实是 (填选项字母)。
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色退去
B.滴入酚酞溶液变红,再加入氯水后红色退去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
(4)现有可逆反应:2A(g)+2B(g) C(g)+3D(s),在密闭容器的容积、温度都相同的条件下,分别从以下两条途径建立平衡:Ⅰ. A、B的起始物质的量均为2 mol,Ⅱ.C、D的起始物质的量分别为2 mol和6 mol。以下说法中正确的是 (填选项字母)。
C(g)+3D(s),在密闭容器的容积、温度都相同的条件下,分别从以下两条途径建立平衡:Ⅰ. A、B的起始物质的量均为2 mol,Ⅱ.C、D的起始物质的量分别为2 mol和6 mol。以下说法中正确的是 (填选项字母)。
A.Ⅰ、Ⅱ两条途径最终达到平衡时,体系内混合气体的百分组成相同
B.达到平衡时,途径Ⅱ所得混合气密度为途径Ⅰ所得混合气密度的2倍
C.达到平衡时,途径ⅡC的平衡浓度大于途径ⅠC的平衡浓度的2倍
(5)在恒容绝热(不与外界交换能量)条件下进行2A (g)+ B(g) 2C(g)+ D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系: 。
2C(g)+ D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。简述该反应的平衡常数与温度的变化关系: 。
| 物质 | A | B | C | D |
| 起始投料/mol | 2 | 1 | 2 | 0 |
I.已知:反应
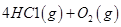
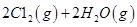
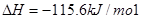
请回答:
 反应生成气态水的热化学方程式__________________________
反应生成气态水的热化学方程式__________________________
II.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为:
它所对应的化学方程式为:_________________________________________________
(2)已知在400℃时,反应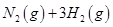
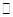
 =0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应
=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应 ____________
____________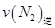 (填:>、<、=、不能确定);
(填:>、<、=、不能确定);
欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积分数增加,
可采取的正确措施是____________(填序号)
A.加催化剂 B.升高温度 C.缩小体积增大压强 D.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应: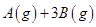
 ,其化学平衡常数K与温度T的关系如下表:
,其化学平衡常数K与温度T的关系如下表:

请完成下列问题:
①判断该反应的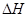 ___________0(填“>”或“<”)
___________0(填“>”或“<”)
②在一定条件下,能判断该反应一定达化学平衡状态的是___________(填序号)。
A. B.容器内压强保持不变
B.容器内压强保持不变
C.A和B的转化率相等 D.混合气体的密度保持不变
查看习题详情和答案>>
I.已知:反应


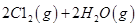

请回答: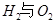 反应生成气态水的热化学方程式__________________________
反应生成气态水的热化学方程式__________________________
II.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为:
它所对应的化学方程式为:_________________________________________________
(2)已知在400℃时,反应

 =0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应
=0.5,则400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应 ____________
____________ (填:>、<、=、不能确定);
(填:>、<、=、不能确定);
欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积分数增加,
可采取的正确措施是____________(填序号)
A.加催化剂 B.升高温度 C.缩小体积增大压强 D.使氨气液化移走
(3)在一定体积的密闭容器中,进行如下化学反应:

 ,其化学平衡常数K与温度T的关系如下表:
,其化学平衡常数K与温度T的关系如下表:
请完成下列问题:
①判断该反应的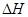 ___________0(填“>”或“<”)
___________0(填“>”或“<”)
②在一定条件下,能判断该反应一定达化学平衡状态的是___________(填序号)。
A.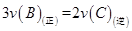 B.容器内压强保持不变
B.容器内压强保持不变
C.A和B的转化率相等 D.混合气体的密度保持不变
CH4(g)+1/2O2(g)
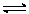 CO(g)+2H2(g);△H=-36kJ/mol……… ①
CO(g)+2H2(g);△H=-36kJ/mol……… ① CH4(g)+H2O(g)
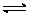 CO(g)+3H2(g);△H=+216kJ/mol………②
CO(g)+3H2(g);△H=+216kJ/mol………② ①下列说法正确的是___________。
A.2H2O(l)=2H2(g)+O2(g) △H=+504kJ/mol
B.当反应①中υ(CH4)正=υ(CO)正时,表明该反应达平衡状态
C.其它条件不变时,增大体系压强,反应①②中甲烷的转化率均增大
D.为维持恒定温度(不考虑热量损失),某反应器中同时发生反应①与②时,消耗甲烷的物质的量之比为6∶1
②某温度下,在100L反应器中充入甲烷和水蒸汽的物质的量分别为100mol和300mol 时,假定只发生反应CH4(g)+H2O(g)
 CO(g)+3H2(g)。当甲烷的转化率为0.5时,此时平衡常数为______________。
CO(g)+3H2(g)。当甲烷的转化率为0.5时,此时平衡常数为______________。(2)发蓝液是由NaNO3、NaNO2及NaOH配成的,在加热条件下,通过三步反应使铁表面生成一层致密的Fe3O4:
3Fe+NaNO2+5NaOH
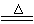 3Na2FeO2+H2O+NH3↑…………①;
3Na2FeO2+H2O+NH3↑…………①;8Fe+3NaNO3+5NaOH+2H2O
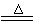 4Na2Fe2O4+3NH3↑……②;
4Na2Fe2O4+3NH3↑……②;以及第三步生成四氧化三铁。请补充第三步反应的方程式并配平:______________________________。
(3)为了使铝表面形成较厚的氧化膜,工业上常用电解硫酸溶液的方法,在阳极上生成氧化铝,写出此时阳极的电极反应:____________________________。
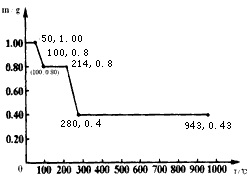
(4)将固体草酸锰MnC2O4·2H2O放在一个可以称出质量的容器里加热。固体质量随温度的变化关系如下图所示(质量单位为g):则214℃时,剩余固体的成分为________________。(填化学式);在280℃时,剩余固体的成分为________________。(填化学式)