摘要:20.要注意试题中小括号内的话.专门看.2l.回答简答题.一定要避免“简单化 .要涉及原理.应该有因有果.答到“根本 .
网址:http://m.1010jiajiao.com/timu_id_428332[举报]
要提纯下列物质(括号内物质为杂质),实验操作最合理的是( )
A.CO2(SO2):通入盛有品红溶液的洗气瓶
B.己烷(己烯):加入足量的溴水,充分振荡,静置分层后分离
C.硫酸铁溶液(硫酸亚铁):通入足量氯气,充分反应后加热,使多余氯气逸出
D.Mg(OH)2[Ca(OH)2]:放入水中调成浆状后,加入足量MgCl2溶液,充分搅拌,过滤,沉淀用蒸馏水洗涤
查看习题详情和答案>>
要提纯下列物质(括号内物质为杂质),实验操作最合理的是
A.CO2(SO2):通入盛有品红溶液的洗气瓶?
B.己烷(己烯):加入足量的溴水,充分振荡,静置分层后分离
C.硫酸铁溶液(硫酸亚铁):通入足量氯气,充分反应后加热,使多余氯气逸出?
D. Mg(OH)2[Ca(OH)2]:放入水中调成浆状后,加入足量MgCl2溶液,充分搅拌,过滤,沉淀用蒸馏水洗涤
查看习题详情和答案>>I、摩尔盐制备:将绿矾(FeSO4·7H2O)硫酸铵以相等物质的量混合可制得摩尔盐晶体。根据下图回答
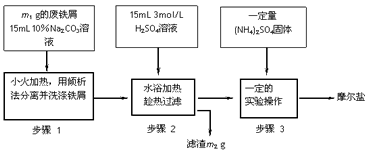
(1)步骤1中Na2CO3的主要作用是____________________。
(2)步骤3中,加入(NH4)2SO4固体后,要得到摩尔盐晶体,需经过的实验操作包括:加热蒸发、
__________、____________。
(3)步骤3中:加热是为了蒸发溶剂,浓缩结晶,应加热到___________时,停止加热。不能蒸干的原因是______________________。
II、产品中Fe2+的定量分析
将称取KMnO4固体并溶于水配成0.2mol·L-1 250mL溶液。再称取8.0g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2mol·L-1 KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积20.00Ml。 (4)配制250mLKMnO4溶液,所需的主要仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需要的玻璃仪器有
_______________ 。
(5)本实验指示剂是____________(填字母)。
A.甲基橙 B.石蕊 C.酚酞 D.不需要
(6)在滴定的过程中,要注意:
①使滴定管内的标准KMnO4溶液滴入锥形瓶中;
②_____________________________________;
③眼睛注意观察锥形瓶中溶液颜色的变化和加入KMnO4溶液的速度;
④接近终点时应该减慢加入KMnO4溶液的速度。当____________,即达到滴定终点。
(7)写出该反应中Fe2+被氧化的离子方程式_____________________________,则该产品中Fe2+的质量分数为______________。
查看习题详情和答案>>
(2)步骤3中,加入(NH4)2SO4固体后,要得到摩尔盐晶体,需经过的实验操作包括:加热蒸发、
__________、____________。
(3)步骤3中:加热是为了蒸发溶剂,浓缩结晶,应加热到___________时,停止加热。不能蒸干的原因是______________________。
II、产品中Fe2+的定量分析
将称取KMnO4固体并溶于水配成0.2mol·L-1 250mL溶液。再称取8.0g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2mol·L-1 KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积20.00Ml。 (4)配制250mLKMnO4溶液,所需的主要仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需要的玻璃仪器有
_______________ 。
(5)本实验指示剂是____________(填字母)。
A.甲基橙 B.石蕊 C.酚酞 D.不需要
(6)在滴定的过程中,要注意:
①使滴定管内的标准KMnO4溶液滴入锥形瓶中;
②_____________________________________;
③眼睛注意观察锥形瓶中溶液颜色的变化和加入KMnO4溶液的速度;
④接近终点时应该减慢加入KMnO4溶液的速度。当____________,即达到滴定终点。
(7)写出该反应中Fe2+被氧化的离子方程式_____________________________,则该产品中Fe2+的质量分数为______________。
要提纯下列物质(括号内物质为杂质),实验操作最合理的是
- A.CO2(SO2):通入盛有品红溶液的洗气瓶后收集
- B.Fe2+(Fe3+):加KSCN溶液后过滤
- C.Cl2(HCl):通过盛有饱和氯化钠水溶液的洗气瓶后收集
- D.氯化铵溶液(FeCl3):加足量NaOH溶液后过滤
实验来源于生活且服务于生活,请回答些列问题:
(1)正确的实验操作是实验成功的重要因素,下列实验操作错误的是
(2)由图的装置中,干燥烧瓶内盛有某种气体,烧杯和滴定管内盛放某种液体.挤压滴管的胶头,下列与实验事实不相符的是
A.CO2(NaHCO3溶液)/无色喷泉B.NH3(H2O含酚酞)/红色喷泉C.H2S(CuSO4溶液)/黑色喷泉D.HCl(AgNO3溶液)/白色喷泉
(3)设计学生实验要注意安全、无污染、现象明显.根据启普发生器原理,可用底部有小孔的试管制简易的气体发生器(见图).若关闭K,不能使反应停止,可将试管从烧杯中取出(会有部分气体逸散).下列气体的制取宜使用该装置的是
A.用二氧化锰(粉末)与浓盐酸制氯气
B.用锌粒与稀硫酸制氢气
C.用碳酸钠固体与盐酸制二氧化碳
D.用碳酸钙(块状)与稀硫酸制二氧化碳
(4)为提纯下列物质(括号内为杂质),选用的试剂和分离方法都正确的是
A.①②B.①③C.只有③D.③④

查看习题详情和答案>>
(1)正确的实验操作是实验成功的重要因素,下列实验操作错误的是
D
D
(2)由图的装置中,干燥烧瓶内盛有某种气体,烧杯和滴定管内盛放某种液体.挤压滴管的胶头,下列与实验事实不相符的是
A
A
(注:不考虑导管被堵塞)A.CO2(NaHCO3溶液)/无色喷泉B.NH3(H2O含酚酞)/红色喷泉C.H2S(CuSO4溶液)/黑色喷泉D.HCl(AgNO3溶液)/白色喷泉
(3)设计学生实验要注意安全、无污染、现象明显.根据启普发生器原理,可用底部有小孔的试管制简易的气体发生器(见图).若关闭K,不能使反应停止,可将试管从烧杯中取出(会有部分气体逸散).下列气体的制取宜使用该装置的是
B
B
A.用二氧化锰(粉末)与浓盐酸制氯气
B.用锌粒与稀硫酸制氢气
C.用碳酸钠固体与盐酸制二氧化碳
D.用碳酸钙(块状)与稀硫酸制二氧化碳
(4)为提纯下列物质(括号内为杂质),选用的试剂和分离方法都正确的是
B
B
| 物质 | 试剂 | 分离方法 | |
| ① | 硝酸钾(氯化钠) | 蒸馏水 | 重结晶 |
| ② | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
| ③ | 乙醇(水) | 生石灰 | 蒸馏 |
| ④ | SiO2(Al2O3) | NaOH溶液 | 过滤 |
